Die Hans und Ilse Breuer-Stiftung vergibt seit 2006 bis zu drei Stipendien jährlich an den exzellenten wissenschaftlichen Nachwuchs. Bislang wurden 36 Stipendiatinnen und Stipendiaten gefördert; Details dazu finden Sie weiter unten.

- für die Grundlagenforschung an Promovierende / Doktoranden naturwissenschaftlicher Fächer wie z.B. Biologie, Biochemie oder Chemie, aber auch der Human- und Tiermedizin und
- für die Versorgungsforschung an Promovierende / Doktoranden z.B. der Versorgungsforschung, Gesundheitswissenschaften, Humanmedizin, Psychologie, Epidemiologie, Public Health, Sozialwissenschaften, Soziologie, Statistik und Biometrie.
Bewerbungsverfahren und Vergabe der Förderleistungen
Bewerbungen sind in englischer Sprache bis zum 30. September 2023 elektronisch an das Kuratorium (info@breuerstiftung.de) zu richten. Die Bewerbung soll insgesamt max. 5 Seiten umfassen und in Arial (Schriftgrad 11, Zeilenabstand 1,5) verfasst werden. Der Inhalt der Bewerbung muss sich an folgendem Muster orientieren. Das Scientific Advisory Board (SAB) wertet die eingehenden Bewerbungen aus und gibt dem Kuratorium eine Empfehlung. Das Kuratorium entscheidet auf dieser Basis über die Vergabe der Stipendien.
In besonderen Ausnahmefällen können auch Anträge von Bewerbern außerhalb des DZNE berücksichtigt werden, bspw. wenn deren Institution eng mit dem DZNE kooperiert. Das Stipendium besteht aus einem Grundbetrag von monatlich 2.300 EUR sowie einem Pauschalbetrag für Sach- und Reisekosten in Höhe von 1.000 EUR jährlich. Das Stipendium wird an das DZNE zur Finanzierung einer Doktorandenstelle (Entgeltgruppe E13, 65%) ausgezahlt. Sollte der monatliche Betrag der Finanzierung durch die Breuer-Stiftung zur Deckung der Gesamtkosten der Doktorandenvergütung nicht ausreichen, übernimmt das DZNE die darüber hinausgehenden Personalkosten. Das Stipendium wird für 36 Monate bewilligt. Auf begründeten Antrag kann das Stipendium um weitere 12 Monate verlängert werden.
Stipendiaten
Hier erfahren Sie, welche herausragenden Nachwuchswissenschaftler die Hans und Ilse Breuer-Stiftung derzeit fördert beziehungsweise gefördert hat. Neben dem Lebenslauf der Kandidaten finden Sie auch eine Projektbeschreibung des jeweiligen Promotionsprojektes.
Projektbeschreibung
Ein vielversprechender Ansatz sozialmedizinischer Forschung, das Risiko an Demenz zu erkranken zu reduzieren, liegt in der Erforschung und Modifizierung von Risikofaktoren. Die Lancet Commission on Dementia prevention, intervention and care hat diesbezüglich 12 modifizierbare Risikofaktoren definiert, die für bis zu 40% des Risikos als verantwortlich gelten. Während die Evidenz bezüglich Risikofaktoren und Prävention, auch durch Lebensstil-Interventionen, fortschreitet, bleibt der Einfluss und Zusammenhang von Migrationshintergrund bisher weitgehend ungeklärt. Jedoch ist das Thema Migration äußerst relevant: Im Jahr 2022 hatten laut Mikrozensus mehr als 23% der in Deutschland lebenden Menschen einen Migrationshintergrund, wobei die Zahl aufgrund aktueller Weltgeschehnisse tendenziell als zunehmend erwartet werden kann.
Bisherige Evidenz zu einzelnen Risikofaktoren für Demenz liefern Hinweise, dass Migrationserfahrungen in diesem Zusammenhang von Relevanz sein könnten. Allen voran ist psychische Gesundheit für Menschen mit Migrationshintergrund von besonderer Bedeutung. So ist, untere anderem durch erlebte Fluchterfahrung, von einer besonderen Anfälligkeit für Traumata, Stress und Ängsten auszugehen. Gleichzeitig können nach einer Migration, aber auch bei Personen in 2. Generation, Ausgrenzungs- und Diskriminierungserfahrungen, kulturelle oder sprachliche Barrieren oder der Zugang zu Gesundheitsversorgung als weitere mögliche psychosoziale Risikofaktoren gesehen werden. Nicht zuletzt wird in ersten wissenschaftlichen Studien von Ungleichheit im Zugang und bei Bedürfnissen von Versorgung Demenzerkrankter mit Migrationshintergrund berichtet.
In dem von der Hans und Ilse Breuer-Stiftung geförderten Projekt soll dem übergeordneten Ziel nachgegangen werden, sowohl Risikofaktoren bei Personen mit Migrationshintergrund näher zu verstehen, als auch das Potenzial zur Demenzprävention zu elaborieren. Um dies zu erreichen, soll in einem ersten Schritt herausgearbeitet werden, was bisher bekannt ist über den Zusammenhang von Migrationshintergrund und Demenzrisiko. Anschließend soll untersucht werden, wie sich bekannte Risikofaktoren bei Personen mit Migrationshintergrund verhalten und ob und inwiefern sich diese womöglich von Personen ohne Migrationserfahrung unterscheiden. In einem dritten Schritt soll abschließend anhand qualitativer Methodik erarbeitet werden, wie verbreitet das Wissen und die Wahrnehmung von Prävention bei Personen mit Migrationshintergrund ist und im Sinne einer möglichen Verbesserung der Prävention analysiert werden, wie Personen mit Migrationshintergrund die Unterstützung und den Zugang bezüglich Prävention wahrnehmen.
Ergebnisse des Projektes sollen zu einem tiefergehenden wissenschaftlichen Verständnis der Relevanz von Migrationshintergrund für das Demenzrisiko beitragen. Implikationen für zukünftige Forschungsvorhaben, aber auch für die Praxis sollen zudem das Potenzial verbessern, Prävention für ebendiese Personengruppe zielgerichteter und leichter zugänglich zu machen und damit dem vielversprechenden Ansatz von Risikoprävention um einen wichtigen Aspekt ergänzen.
Lebenslauf
| Name | Felix Wittmann | |
| Geburtstag | 30.04.1995 | |
| Geburtsort | Freiburg i. Br. | |
| Bildung | ||
| 2018 – 2022 | Studium der Soziologie (Master of Arts), Universität Leipzig | |
| 2020 | Studium der Soziologie (Auslandssemester), Latvijas Universitate, Lettland | |
| 2014 – 2018 | Studium der Soziologie (Bachelor of Arts), Universität Mannheim | |
| 2016 | Studium der Soziologie (Auslandssemester), Università degli Studi di Firenze, Italien | |
| Berufliche Erfahrung | ||
| Seit 07/2022 | Wissenschaftlicher Mitarbeiter, Institut für Sozialmedizin, Arbeitsmedizin und Public Health (ISAP), Arbeitsgruppe Epidemiology & Population Brain Health | |
| 06/2019-08/2020 02/2021-06/2022 |
Wissenschaftliche Hilfskraft, Institut für Sozialmedizin, Arbeitsmedizin und Public Health (ISAP), Arbeitsgruppe Epidemiology & Population Brain Health | |
| 03/2017 – 08/2018 | Studentische Hilfskraft, Mannheim Institute of Public Health, Social and Preventive Medicine (MIPH), Universität Heidelberg | |
| Publikationen | ||
| Wittmann, F. G., Zülke, A., Pabst, A., Luppa, M., Thyrian, J.R., Kästner, A., Hoffmann, W., Kaduszkiewicz, H., Döhring, J., Escales, C., Gensichen, J., Zöllinger, I., Kosilek, R.P., Wiese, B., Oey, A., König, H.-H., Brettschneider, C., Frese, T. & Riedel-Heller, S.G. (2023) COVID-19 government measures and their impact on mental health: a cross-sectional study of older primary care patients in Germany. Front. In Public Health, DOI: 10.3389/fpubh.2023.1141433 | ||
| Wittmann, F. G., Zülke, A., Schultz, A., Claus, M., Röhr, S., Luppa, M., & Riedel-Heller, S. G. (2023). Beneficial and Impeding Factors for the Implementation of Health-Promoting Lifestyle Interventions—A Gender-Specific Focus Group Study. International Journal of Environmental Research and Public Health, 20(4), 3520. DOI: 10.3390/ijerph20043520 | ||
| Zülke, A. E., Riedel-Heller, S. G., Wittmann, F., Pabst, A., Röhr, S., & Luppa, M. (2022). Gender-Specific Design and Effectiveness of Non-Pharmacological Interventions against Cognitive Decline—Systematic Review and Meta-Analysis of Randomized Controlled Trials. The Journal of Prevention of Alzheimer’s Disease, 10, 69–82. DOI: 10.14283/jpad.2022.80 | ||
| Röhr, S., Wittmann, F., Engel, C., Enzenbach, C., Witte, A. V., Villringer, A., Löffler, M., & Riedel-Heller, S. G. (2021). Social factors and the prevalence of social isolation in a population-based adult cohort. Social psychiatry and psychiatric epidemiology, 1-10. DOI: 10.1007/s00127-021-02174-x | ||
| Zuelke, A. E., Riedel-Heller, S. G., Wittmann, F., Pabst, A., Roehr, S., & Luppa, M. (2021). Gender-specific design and effectiveness of non-pharmacological interventions against cognitive decline and dementia–protocol for a systematic review and meta-analysis. PloS one, 16(8), e0256826. DOI: 10.1371/journal.pone.0256826 | ||
| Roehr, S., Wittmann, F., Jung, F., Hoffmann, R., Renner, A., Dams, J., Grochtdreis, T., Kersting, A., König, H.H., & Riedel-Heller, S. G. (2019). Strategies to recruit refugees for intervention studies: lessons learned from the“ Sanadak“ Trial. Psychotherapie, Psychosomatik, Medizinische Psychologie, 69(12), 484-489. DOI: 10.1055/a-1030-4570 | ||
| Reljic, D., Wittmann, F., & Fischer, J. E. (2018). Effects of low-volume high-intensity interval training in a community setting: a pilot study. European journal of applied physiology, 118(6), 1153-1167. DOI: 10.1007/s00421-018-3845-8 | ||

Projektbeschreibung
Beitrag der Gitterzellen zu überdurchschnittlicher und pathologischer Alterung
Die Alzheimer-Krankheit (AD) ist eine neurodegenerative Erkrankung, die durch Defizite im episodischen Gedächtnis (EM) und in der räumlichen Navigation gekennzeichnet ist. Um das Fortschreiten der Krankheit zu verhindern oder abzumildern, werden derzeit große Anstrengungen unternommen, um 1) neuronale Faktoren zu finden, welche die Krankheitsresistenz fördern, und 2) neuronale Grundlagen der Alzheimer-Krankheit im Frühstadium. Gitterzellen (GC), hochspezialisierte Zellen im entorhinalen Kortex, die in einem sechseckigen Muster feuern, wenn sich der Navigator durch den Raum bewegt, bieten einen vielversprechenden Weg, um beide Ziele zu erreichen. Über ihre Bedeutung für die Navigation hinaus wird angenommen, dass sich die Funktion der GC ganz allgemein auf das episodische Gedächtnis erstreckt, d.h. auf das Gedächtnis für Ereignisse, die objektbezogene („was“), räumliche („wo“) und zeitliche („wann“) Komponenten enthalten. Insbesondere wird vermutet, dass die GCs das räumlich-zeitliche Gerüst des EM bilden, was die EM-Beeinträchtigungen bei Alzheimer erklären könnte.
Um die Krankheitsresistenz zu untersuchen, konzentriert sich die vorliegende Arbeit auf SuperAger, d. h. Erwachsene über 80 Jahre mit einer EM-Leistung, welche der von Erwachsenen entspricht, die 30 Jahre jünger sind als sie. SuperAgers weisen eine Resistenz gegen altersbedingte neurofibrilläre Degeneration im entorhinalen Kortex auf, wo sich die GCs befinden. Wenn die GCs tatsächlich die EM unterstützen, könnte eine höhere Integrität der GCs die Ursache für ihre überlegene EM-Leistung sein. Das erste Ziel dieser Arbeit besteht darin festzustellen, ob die überlegene EM-Leistung bei älteren Erwachsenen durch die Erhaltung der Integrität der Gitterzellen erklärt werden kann.
Um die neuronalen Grundlagen der Alzheimer-Krankheit im Frühstadium zu erforschen, wird in dieser Arbeit der Beitrag der Randzellen zum Feuern der Gitterzellen untersucht und ob dieser Beitrag im Frühstadium der Alzheimer-Krankheit gestört ist. Grenzzellen feuern in der Nähe von Umgebungsgrenzen (z. B. Wänden) und sollen die Rasterzellen unterstützen, so dass Begegnungen mit Umgebungsgrenzen die GC-Feuerfelder korrigieren. Somit könnten Defizite in der Grenzkodierung zu einer Beeinträchtigung der Gitterkodierung und folglich der Navigationsleistung führen, was möglicherweise die Tendenz von Menschen mit Alzheimer-Risiko erklärt, näher an Umweltgrenzen zu navigieren. Das zweite Ziel der Dissertation besteht darin, zu prüfen, ob eine gestörte Grenzkodierung bei Alzheimer die GC-Stabilisierung verhindert und als zugrundeliegender neuronaler Mechanismus wirkt, der zu Navigationsdefiziten führt.
Mit einer Kombination aus immersiver virtueller Realität, modellbasierter funktioneller Magnetresonanztomographie und einem neu entwickelten Berechnungsrahmen wird das Hauptziel der Dissertation darin bestehen, den Beitrag der Gitterzellen zur Aufrechterhaltung der EM im Alter und die neuronalen Mechanismen hinter ihrer Störung bei Alzheimer zu untersuchen.
Lebenslauf
Academic Curriculum Vitae
Date of birth: 03-06-1989
Place of birth: Krokom, Sweden
Academic work experience
2022 – present PhD Student, Aging, Cognition and Technology Lab
German Center for Neurodegenerative Diseases (DZNE), Magdeburg
2020 – 2022 Project Assistant, Anna Rieckmann Lab
Umeå Center for Functional Brain Imaging (UFBI), Umeå University
Education
2020 – 2022 Master of Science in Cognitive Science <
Umeå University, Sweden
- Thesis: “The Aging Hippocampus: Uncal Apex Position Predicts Episodic Memory Performance”, supervised by Dr. Kristin Nordin and Dr. Alireza Salami
2016 – 2019 Bachelor of Science in Cognitive Neuroscience
Skövde University, Sweden
- Thesis: “The Blacked-Out Brain: Neural Mechanisms of Unconsciousness in Anaesthesia and Disorders of Consciousness”, supervised by Prof. Antti Revonsuo
Publications
Nordin, K. Bahrd, P., Andersson, M., Salami, A. (in preparation). Position of the uncal apex as a predictor of memory function across the adult lifespan.
Stiernman, L., Grill, F., McNulty, C., Bahrd, P., Panes Lundmark, V., Axelsson, J., Salami, A., Rieckmann, A. (2023). Widespread BOLD signal overactivations during cognitive control in older adults are not paralleled by task-induced increases in glucose metabolism.

Projektbeschreibung
Identifizierung neuer Krankheitsnetzwerke bei sporadischer und C9orf72 ALS/FTD
Neurodegenerative Erkrankungen haben im Allgemeinen ein gemeinsames Merkmal: die fortschreitende Degeneration von Neuronen im zentralen Nervensystem. Während die genauen Ursachen nach wie vor unklar sind, tragen mehrere Faktoren zu ihrer Entstehung bei. Die genetische Veranlagung spielt eine entscheidende Rolle, wobei bestimmte Genmutationen die Anfälligkeit erhöhen. Auch Umweltfaktoren, einschließlich der Exposition gegenüber Toxinen und Schadstoffen, können einen Beitrag leisten. Darüber hinaus ist das Alter ein bedeutender Risikofaktor, da die Häufigkeit neurodegenerativer Erkrankungen mit zunehmendem Alter ansteigt. Trotz umfangreicher Forschungsarbeiten ist das komplizierte Zusammenspiel von genetischen, umweltbedingten und altersbedingten Faktoren, die diese Krankheiten auslösen, nach wie vor kaum verstanden.
Amyotrophe Lateralsklerose (ALS) und Frontotemporale Demenz (FTD) sind zwei unterschiedliche, aber zusammenhängende neurodegenerative Erkrankungen, die gemeinsame Merkmale aufweisen. ALS und FTD beinhalten fortschreitende Degeneration von Nervenzellen, wobei der Schwerpunkt bei der ALS auf den motorischen Neuronen liegt. Obwohl die meisten Fälle sporadisch auftreten und die Ätiologie unklar ist, spielt die genetische Veranlagung nach wie vor eine wichtige Rolle. Autosomal-dominante Mutationen, die ALS oder FTD mit hoher Penetranz verursachen, wurden in mehr als 30 Genen identifiziert, darunter auch in der häufigen C9orf72-Repeat-Expansion. Die mutierten Gene sind mit der Proteinaggregation, dem Proteinabbau über die Autophagie und das Proteasom verbunden, Entzündungen und den RNA-Stoffwechsel. Insbesondere führen die meisten pathogenen Mutationen zu ALS oder FTD mit charakteristischen neuronalen TDP-43-Einschlüssen, was darauf hindeutet, dass mehrere verschiedene Mechanismen auf einen gemeinsamen nachgeschalteten Weg konvergieren.
Daher möchte ich während meiner Promotion das komplizierte funktionelle Zusammenspiel zwischen ALS- und FTD-Genen untersuchen. FTD-Genen zu untersuchen, um neue Signalwege und molekulare Knotenpunkte aufzudecken, die bei Krankheiten, die Patienten ohne bekannte Mutationen. Zunächst werde ich die Interaktion dieser Gene in funktionellen Assays in (Reporter-)Zelllinien und iPSC-abgeleiteten Neuronen testen, um herauszufinden, welche Gene z. B. den endolysosomalen Weg und die zytoplasmatische Fehllokalisierung von TDP-43 beeinflussen.
Am Ende dieses Projekts wollen wir die molekularen Mechanismen hinter den unerwarteten Interaktionen von ALS-Genen, wie Poly-GA/C9orf72 und TBK1, zu verstehen, die möglicherweise Krankheitsmechanismen aufdecken, die auch für die sporadische ALS relevant sind.
Lebenslauf
HUSEYIN BERKCAN ISILGAN
EDUCATION
- LMU Graduate School of Systemic Neurosciences 10.2023-ongoing
PhD student in GSN
- DZNE Munich 11.2022 – ongoing
PhD student at Edbauer group
- University of Milan 10.2019 – 04.2022
MSc Molecular Biology of Cell
- Bahçeşehir University 01.2016 – 06.2019
BSc Molecular Biology and Genetics
- Bahçeşehir University 01.2018 – 06.2019
BSc Minor Degree Software Engineering, Information Systems
ABSTRACTS
GISN,2021
ACETYLATED ALPHA-TUBULIN AND STRESS GRANULES: NOVEL INSIGHTS INTO LEWY BODYFORMATION
SCHOLARSHIPS
UNIMI Scholarships for promising graduates (May 2022-Nov 2023)
Diritto allo Studio (DSU), University of Milan (2019-2021)
Bahcesehir University, Education Scholarship (2015-2019)
PUBLICATIONS
Mazzetti S, Giampietro F, Isilgan HB, et al. Linking acetylated α-Tubulin redistribution toα Synuclein pathology in brain of Parkinson’s disease patients. 2022, pre-print biorxivdoi:10.1101/2022.12.29.522226
Calogero AM, Basellini MJ, Isilgan HB, et al. Acetylated α-Tubulin and α-Synuclein: PhysiologicalInterplay and Contribution to α-Synuclein Oligomerization. Int J Mol Sci. 2023;24(15):12287.Published 2023 Jul 31. doi:10.3390/ijms241512287.

Projektbeschreibung:
Erforschung der mitochondrialen Vielfalt im zentralen Nervensystem
Mitochondrien sind kleine Organellen, die einen Großteil der von den Zellen benötigten Energie liefern. Darüber hinaus sind sie von zentraler Bedeutung für viele Stoffwechselvorgänge, speichern Kalzium und können den Zelltod auslösen. Mitochondrien spielen also eine wesentliche Rolle für das Leben der meisten Zellen. Die Erhaltung gesunder Mitochondrien stellt jedoch eine Herausforderung für Nervenzellen dar, die extrem lange, mit Mitochondrien gefüllte, Fortsätze haben. Einige Klassen von Neuronen (wie die sogenannten cholinerge Neuronen“, die einen speziellen Neurotransmitter freisetzen, und zwar Acetylcholin) haben zusätzliche Herausforderungen, da sie spezielle Biosynthesewege benötigen oder ihnen die umfassende Unterstützung von den Gliazellen fehlt, welche andere Neuronen umgeben. Es ist unbekannt, ob alle oder einige (z. B. die in distalen Prozessen) Mitochondrien in solchen Neuronen spezialisiert sind, um diese Herausforderungen zu bewältigen.
Um diese Frage zu beantworten und mitochondriale Anpassungen in diesem Zusammenhang zu untersuchen, werde ich einen neu entwickelten Ansatz namens ‚MitoTag‘ verwenden, der es mir ermöglicht, Mitochondrien aus einem gewünschten Zelltyp zu isolieren. In einer vorläufigen Studie wurde ein mitochondrialer Metaboliten-Transporter identifiziert als ein stark angereichertes Protein in cholinergen Neuronen, die für motorische und kognitive Funktionen entscheidend und auch sehr anfällig für Neurodegeneration sind. Interessanterweise steht der von uns identifizierte Transporter in Verbindung mit einer seltenen menschlichen neuromuskulären Erkrankung und möglicherweise mit dem Stoffwechselweg für die Acetylcholin Synthese.
Über den spezifischen Kontext dieser einen molekularen Anpassung hinaus, wird meine Studie auch allgemeine Einblicke in die „mitochondriale Vielfalt“ geben, die erklären könnte, warum Defekte in einer Organelle, die für fast alle Zellen wichtig ist, dennoch zu sehr spezifischen Erkrankungen des Nervensystems führen können.
Lebenslauf
| Name | Adrían Martí Pastor |
| Geburtstag | 25.02.1997 |
| Geburtsort | Valencia, Spanien |
Bildung |
|
| Seit 10/2021 | Wissenschaftlicher Mitarbeiter, Doktorand | Institut für Neuronale Zellbiologie (TUM-NCB) und Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE) in München bei Prof. Dr. Thomas Misgeld “Neuronal mitochondria in the central nervous system: exploring inter- and intracellular diversity” |
| 01/2021 – 10/2021 | Masterarbeit | Max-Delbrück-Centrum für Molekulare Medizin Prof. Dr. Erich E. Wanker, Berlin “Mechanistic pathways in Huntington’s disease from a protein-protein interaction network” |
| 10/2019 – 10/2021 | Experimentelle und klinische Neurowissenschaften, MSc. | Universität Regensburg |
| 09/2015 – 07/2019 | Biochemie und Biomedizinische Wissenschaften, BSc. | Universität Valencia |
Publikationen |
|
| de Mello, P. N., Fecher, C., Marti Pastor, A., Perocchi, F., Misgel, T. (2022). Ex vivo immunocapture and functional characterization of cell type-specific mitochondria using MitoTag mice. Accepted 06.12.2022 in Nature Protocols. |
|
| Düking, T., Spieth, L., Berghoff, S. A., Piepkorn, L., Schmidke, A. M., Mitkovski, M., … Marti Pastor, A., Misgeld T., … & Saher, G. (2022). Ketogenic diet uncovers differential metabolic plasticity of brain cells. Science Advances, 8(37), eabo7639. |
|
| Klockmeier, K*., Ramos, E. S*., Raskó, T., Marti Pastor, A., & Wanker, E. E. (2021). Schizophrenia risk candidate protein ZNF804A interacts with STAT2 and influences interferon-mediated gene transcription in mammalian cells. Journal of Molecular Biology, 433(19), 167184. |

By loading this video, you agree to the privacy policy of Youtube.
“Durch meine Forschung möchte ich dazu beitragen, das derzeitige Verständnis der Krankheitsmechanismen von Morbus Parkinson zu erweitern und somit neue therapeutische Ansatzpunkte zu erschließen.”
Projektbeschreibung:
Das Vorkommen neurodegenerativer Erkrankungen nimmt mit der zunehmenden Alterung unserer Bevölkerung rapide zu und erfordert dringend die Entwicklung neuer Behandlungsmethoden. Bei vielen dieser Krankheiten ist jedoch immer noch unbekannt, was genau die Degeneration der Nervenzellen im Gehirn verursacht. Bei der zweithäufigsten neurodegenerativen Erkrankung, der Parkinson-Krankheit (PD), beobachten Forscher das selektive Absterben sehr spezialisierter Gehirnzellen, der dopaminergen Neuronen in der Substantia nigra, einer Region im Mittelhirn. Diese Nervenzellen, die den Neurotransmitter Dopamin freisetzen, sind besonders wichtig für die Steuerung von Bewegungen, sodass ihr Verlust bei den Betroffenen zu langsamen und zittrigen Bewegungen führt.
Wichtige Hinweise darauf, was diese Zellen so anfällig macht, kommen von Patienten mit seltenen, vererbbaren Formen der Parkinson-Krankheit, bei denen wir eine bestimmte Mutation als Krankheitsauslöser identifizieren können. So führt beispielsweise eine Mutation im DJ-1-Gen bei den betroffenen Personen zu einer frühen Entwicklung von PD. In Neuronen mit beeinträchtigter Funktion des DJ-1 Proteins beobachteten wir, dass es Veränderungen des Neurotransmitters Dopamin selbst waren, die als Vermittler einer schädlichen Kaskade zum Zelltod führten (Burbulla et al., 2017). Diese Vorgänge wurden auch in Neuronen von Patienten mit der viel häufigeren sporadischen Form von Parkinson beobachtet.
Traditionell wurde PD als eine rein neuronale Erkrankung betrachtet. Neue Studien deuten jedoch darauf hin, dass auch Veränderungen in anderen Arten von Gehirnzellen zum Absterben der Neurone bei PD beitragen könnten. Ich bin besonders daran interessiert zu untersuchen wie deren Interaktionen die Krankheit beeinflussen. Interessanterweise ist das DJ-1 Protein auch in Astrozyten reichlich vorhanden. Astrozyten sind unterstützende Zellen im Gehirn, die über eine Vielzahl von Signalmolekülen eng mit Neuronen kommunizieren. Der Schwerpunkt meines Promotionsprojekts liegt daher darauf zu untersuchen, wie der Verlust von DJ-1 die Signalmoleküle der Astrozyten beeinflusst und sich auf die Kommunikation zwischen Astrozyten und Neuronen auswirkt. Wir glauben, dass DJ-1 in Astrozyten eine Schlüsselrolle beim Schutz dopaminerger Neurone spielt und dessen Verlust wiederum zum Fortschritt der Krankheit beitragen könnte. Somit könnte DJ-1 in Astrozyten einen möglichen Ansatzpunkt für die Entwicklung neuer und besserer Medikamente darstellen.
Um die Beteiligung von Astrozyten an der Neurodegeneration zu untersuchen, werde ich mit so genannten induzierten pluripotenten Stammzellen (iPSCs) arbeiten. Mit dieser spannenden Technik können Hautzellen von Patienten in Stammzellen umgewandelt werden, die wir dann wiederum in unserem Labor in Neurone und Astrozyten umwandeln können. Im Rahmen meiner Promotion werde ich somit Astrozyten von PD Patienten mit einer DJ-1-Mutation, sporadischen PD Patienten und von gesunden Probanden züchten und ihre Signalmoleküle vergleichen. Außerdem werde ich ihre Auswirkungen auf bekannte Krankheitsmechanismen in Neuronen untersuchen und testen, ob die Behandlung von Astrozyten mit pharmazeutischen Wirkstoffen, welche die DJ-1 Funktion beeinflussen, dopaminerge Neuronen vor dem Absterben schützen kann. Die Ergebnisse meiner Forschung werden ein wichtiger Schritt sein um die Kommunikation zwischen Astrozyten und Neuronen zu verstehen und somit die neuronale Anfälligkeit bei Parkinson zu entschlüsseln.
Lebenslauf
| Name | Annika Wagener |
| Geburtstag | 29.09.1995 |
| Geburtsort | Würzburg |
Bildung |
|
| Seit 10/2021 | PhD student | German Center for Neurodegenerative Diseases (DZNE) & Ludwig Maximilian University (LMU) Munich, Germany “Astrocyte-neuron crosstalk in Parkinson’s disease – the impact of non cell-autonomous mechanisms in neurodegeneration” Supervisor: Prof. Dr Lena Burbulla |
| 10/2021 – 12/2021 | Visiting Researcher | Luxembourg Centre for Systems Biomedicine, University of Luxembourg Advisors: Dr Ibrahim Boussaad and Prof. Rejko Krüger |
| 10/2018 – 04/2021 | Master of Science (MSc) Molecular Biosciences with Major Neuroscience| Ruprecht Karl University Heidelberg, Germany |
| 08/2020 – 04/2021 | MSc thesis | Institute for Stroke and Dementia Research, LMU Munich “A High-throughput workflow for CRISPR editing in human iPSCs” Supervisor: Prof. Dr Dominik Paquet |
| 09/2019 – 02/2020 | MSc Research Project | Division of Neurogeriatrics, Karolinska Institute, Sweden “Evaluation of a novel intramembrane protease involved in Alzheimers disease” Supervisors: Dr Simone Tambaro and Prof. Dr Per Nilsson |
| 09/2014 – 06/2018 | Bachelor of Science (BSc Hons) Neuroscience | University of Glasgow, Scotland |
| 09/2017 – 01/2018 | BSc thesis | Research Institute of Neuroscience & Psychology, University of Glasgow “Investigating memantine as a prophylactic treatment for ischaemic stroke” Supervisor: Dr Chris McCabe |
Stipendien |
|
| 10/2021 | Awarded „Thiemann Visitor Programm“ Scholarship by the Thiemann Stiftung |
Publikation |
|
| Dickie, D.A., Gardner, K.*, Wagener, A.*, Wyss, A., Arba, F., Wardlaw, J. M., Dawson, J. (2019). Cortical thickness, white matter hyperintensities, and cognition after stroke. International Journal of Stroke. doi: 10.1177/1747493019851291 |

By loading this video, you agree to the privacy policy of Youtube.
„Ich möchte dazu beitragen, Gebrechlichkeit als vielversprechendes Gesundheits- und Alter(n)smaß in die deutsche Gesundheitsversorgung und -forschung einzubinden.“
Projektbeschreibung:
Demenz ist eine altersassoziierte Krankheit. Daher ist das Alter und das (gesunde) Altern im Allgemeinen ein Thema von Interesse in der gerontologischen und geriatrischen Forschung. Ziel ist es, (a) die Lebenserwartung und/oder Sterblichkeit vorherzusagen, (b) eine Verbindung zwischen dem Alterungsprozess und der (alltäglichen) Funktionalität herzustellen und (c) potenzielle Therapien und Interventionen zur Verlängerung der Gesundheitsspanne zu bewerten.
Die Vorhersagekraft des chronologischen Alters ist begrenzt und selbstverständlich kann dieses auch nicht beeinflusst werden. Das biologische Alter hingegen wirkt sich direkt und indirekt auf die Funktionalität und Mobilität aus. Die Messbarkeit von Biomarkern ist jedoch in der Routineversorgung nicht einfach und ohne weiteres verfügbar, sie erfordern spezielle Verfahren, Kenntnisse und Fachwissen.
Der Zusammenhang zwischen (biologischem) Alter, Morbidität, Mortalität, (Alltags-)Funktionalität, Mobilität und Gesundheit ist beschreibbar und kann sowohl als Indikator für eine Intervention oder als Ergebnisfaktor einer Intervention in der Routineversorgung verwendet werden. Ein vielversprechendes Konzept hierfür ist Gebrechlichkeit, ein Konzept zur Beschreibung von Personen auf mehreren, gesundheits- und pflegerelevanten Ebenen. Einer der Vorteile der Messung von Gebrechlichkeit im Vergleich zu klinischen Daten ist die Möglichkeit, sie aus vorhandenen Daten abzuleiten, die für einen anderen primären Zweck erhoben wurden. So ist es möglich, Gebrechlichkeit in verschiedenen Personengruppen und in unterschiedlichen Settings ohne übermäßigen Aufwand nachträglich zu messen und erlaubt so Sekundäranalysen zur Untersuchung der Mechanismen des gesunden Alterns.
In der internationalen Forschung und Versorgung ist Gebrechlichkeit bereits deutlich etablierter als in Deutschland. Verschiedene Länder arbeiten seit einigen Jahren an einer standardisierten Implementierung von Gebrechlichkeit-Messungen in der Primär- und Akutversorgung. In Deutschland gibt es verschiedene Assessment-Instrumente, die jedoch nicht einheitlich eingesetzt werden. Mit meinem Promotionsprojekt möchte ich einen Beitrag zur internationalen wissenschaftlichen Diskussion leisten und den Nutzen für die Forschung mit und Versorgung von Menschen mit Demenz aufzeigen.
Um dies zu erreichen, möchte ich einen defizitorientierten Gebrechlichkeits-Index leitfadenbasiert entwickeln und auf bereits existierende Daten einer gesundheitszentrierten Studie mit Menschen mit Demenz (DelpHi-MV) anwenden, um im zweiten Schritt die Verwendbarkeit von Gebrechlichkeit als Endpunkt und/oder Indikator für Interventionen zu bewerten. Im letzten Schritt soll ein Messinstrument für Gebrechlichkeit in der Routineversorgung erprobt und evaluiert werden, hierfür wird die Erhebung in eine Studie integriert, welche sich mit der Implementierung von Studienkonzepten in die Routineversorgung beschäftigt.
Nach drei Jahren soll ein nutzbarer Gebrechlichkeits-Index für die DelpHi-MV-Daten vorliegen, Evidenz über die Zusammenhänge zwischen Intervention und Gebrechlichkeit sowie Empfehlungen zur Nutzung von Gebrechlichkeit in Studien der Versorgungsforschung ausgearbeitet sein.
Lebenslauf
| Name | Melanie Boekholt |
| Geburtstag | 24. 09. 1992 |
| Geburtsort | Viersen |
Bildung und berufliche Vorerfahrungen |
|
| Seit 2019 | Doktorandin, Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE) Site Rostock / Greifswald, AG Thyrian, Interventionelle Versorgungsforschung |
| 2017 – 2019 | Hilfswissenschaftliche Mitarbeiterin am Lehrstuhl für Sozialstruktur und Soziologie alternder Gesellschaften, Prof. Dr. Brandt |
| 2016 – 2019 | Master of Arts in „Alternde Gesellschaften“ an der Technischen Universität Dortmund |
| 2012 – 2016 | Bachelor of Arts in „Gerontologie“ an der Universität Vechta |
Stipendien |
|
| 2021 | Summer School scholarship: “Empirical approaches to aging research” vom Institut für Gerontologie, Vechta |
| 2020 | Conference scholarship for young researchers at the conference „Living and Health in Old Age“ vom Institut für Gerontologie, Vechta |
Publikationen (* Erstautorenschaft) |
|
| Boekholt M* et al. Gesundheitsversorgung der Zukunft – Erkenntnisse und Strategie der (Demenz-) Versorgungsforschung. ZEITSCHRIFT FUR GERONTOLOGIE UND GERIATRIE. 2020; 53(8):735-741. | |
| Klein O*, Boekholt M* et al. Effectiveness of a digitally supported care management programme to reduce unmet needs of family caregivers of people with dementia: study protocol for a cluster randomised controlled trial (GAIN). TRIALS. 2021; 22(1):401. | |
| Kracht F*, Boekholt M* et al. Describing people with cognitive impairment and their complex treatment needs during routine care in the hospital – cross-sectional results of the intersec-CM study. BMC GERIATRICS. 2021; 21(1):425. | |
| Nikelski A*, … , Boekholt M et al. „Das muss man so nehmen.“ Eine Studie zum subjektiven Erleben der Coronapandemie. ZEITSCHRIFT FUR GERONTOLOGIE UND GERIATRIE. 2021; 54(4):359-364. | |
| Thyrian J*, Boekholt M et al. Die Prävalenz an Demenz erkrankter Menschen in Deutschland – eine bundesweite Analyse auf Kreisebene. DER NERVENARZT. 2020; 91(11):1058-1061. | |
| Thyrian J*, … , Boekholt M et al. The situation of elderly with cognitive impairment living at home during lockdown in the Corona-pandemic in Germany. BMC GERIATRICS. 2020; 20(1):540. |

By loading this video, you agree to the privacy policy of Youtube.
„Ich möchte den Beitrag von Medin zur Alzheimer Erkrankung besser verstehen und das Spektrum möglicher Therapieansätze erweitern, um damit Betroffenen und Angehörigen neue Perspektiven zu bieten.“
Projektbeschreibung:
Die Alzheimer-Krankheit stellt eine der häufigsten neurodegenerativen Erkrankungen dar, an der jedes Jahr mehr als 300.000 Menschen in Deutschland neu erkranken. Die Ursache für die sporadisch auftretende Form der Erkrankung ist jedoch trotz großer Forschungsanstrengungen bislang nur unvollständig bekannt und es existieren noch immer keine effizienten Behandlungsmethoden. Studien der vergangenen Jahre heben nun eine Fehlfunktion von Blutgefäßen des Gehirns als einen wichtigen Bestandteil für die Entstehung der Alzheimer-Erkrankung hervor. Zum Beispiel entwickeln über 80% der Erkrankten in den Blutgefäßen des Gehirns Ablagerungen von Beta-Amyloid (Aβ) – eine sogenannte zerebrale Amyloidangiopathie (CAA). Diese führt zu einer Schädigung der Gefäßwände und kann unter anderem intrazerebrale Blutungen auslösen und somit zum Verlust kognitiver Fähigkeiten beitragen.
Im Allgemeinen werden Proteine als Amyloide bezeichnet, wenn sie unlösliche Ablagerungen bilden. Oft sind Amyloide auch mit Krankheiten assoziiert, so trägt z.B. Aβ maßgeblich zur Alzheimer-Erkrankung bei. Das im Menschen am häufigsten vorkommende Amyloid ist jedoch Medin, ein Fragment des deutlich größeren MFG-E8 Proteins, das sich in den Blutgefäßen in beinahe jedem Menschen über 50 Jahren ablagert. Trotz dieser äußerst hohen Prävalenz war die pathologische Relevanz von Medin bis vor kurzem noch ungeklärt. Die Arbeitsgruppe von Dr. Jonas Neher am DZNE Tübingen konnte jedoch kürzlich zeigen, dass Medin sich auch altersbedingt in den Blutgefäßen von Wildtyp Mäusen ablagert und dort die Funktion der Hirnvaskulatur beeinträchtigt. Unabhängige, korrelative Studien anderer Arbeitsgruppen weisen außerdem auf eine erhöhte Menge von Medin in den Hirngefäßen von Patient:innen mit Alzheimer- und vaskulärer Demenz hin. Somit könnte Medin ein neuer Biomarker für die Alzheimer-Erkrankung oder die vaskuläre Demenz sein.
In meinem PhD Projekt, möchte ich nun untersuchen, inwiefern Medin Amyloid zur Alzheimer-Demenz beiträgt. Dazu werde ich, zum Beispiel, in neuen Mausmodellen der Medin Amyloidose überprüfen, ob Medin die Ablagerung von Aβ in zerebralen Blutgefäßen beeinflusst. Weiterhin werde ich untersuchen, ob eine vaskuläre Ablagerung von Medin auch in der Zerebrospinalflüssigkeit von Alzheimer Patient:innen abgebildet wird und daher als molekularer Biomarker für vaskuläre Schäden in der Alzheimer-Erkrankung dienen kann. Ein solcher Biomarker ermöglicht nicht nur die Diagnose und Beobachtung von Patient:innen, sondern kann auch zur effektiveren Entwicklung von Medikamenten beitragen.
Meine Doktorarbeit soll außerdem untersuchen, ob eine Behandlung mit neu entwickelten Antikörpern zur Entfernung von Medin Aggregaten in Blutgefäßen dieser neuen Mausmodelle führen kann, um den Nutzen dieser Antikörper als mögliche Therapie für die humane Pathologie zu evaluieren.
Lebenslauf
| Name | Marleen Veit |
| Geburtstag | 15.04.1997 |
| Geburtsort | Filderstadt |
Ausbildung |
|
| Seit 11/2021 | Promotionsstudentin, AG Neher, DZNE Tübingen. |
| 10/2019 – 08/2021 | Master of Science: Cellular and Molecular Neuroscience, Graduate Training Centre of Neuroscience, International Max Planck Research School, Universität Tübingen. Projekt: “Pathological Effects of Medin Aggregation on the Cerebral Vasculature in a Mouse Model of Cerebral β-Amyloidosis”, AG Neher, DZNE Tübingen. |
| 10/2016 – 09/2019 | Bachelor of Science: Biologie, Universität Tübingen. Projekt: “Epigenetik der Borderline-Persönlichkeitsstörung und Einfluss der Dialektisch Behavioralen Therapie auf die epigenetische Regulation von FKBP5”, AG Nieratschker, Universitätsklinikum Tübingen. |
Andere Aktivitäten |
|
| Seit 05/2021 | Studentische Initiative “Mindful Science”: Gründerin und Leiterin. Förderung mentaler Gesundheit im akademischen Kontext. |
| Seit 01/2021 | Ehrenamtliche Mitarbeiterin bei Verein für Sozialpsychiatrie e.V. |

„Hören Sie auf die Stimme der Betroffenen!
Ich möchte eine Grundlage bilden, um Patientenpräferenzen zu berücksichtigen und in die Demenzversorgung zu integrieren. “
Wiebke Mohr arbeitet seit September 2020 als Doktorandin am Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) in Rostock / Greifswald in der RG Translational Healthcare Research. Ihr Promotionsprojekt konzentriert sich auf Patientenpräferenzen von Menschen mit Demenz (MmD).
„Leider werden häufig angegebene Präferenzen für MmD aufgrund der degenerativen Natur der Krankheiten nicht angemessen berücksichtigt. Eine reduktionistische Sichtweise von MmD, die ihre Persönlichkeit missachtet, behindert die Umsetzung einer auf die Person zugeschnittene Betreuung. Wir glauben, dass MmD Präferenzen für ihre eigene Pflege angeben möchten und durch partizipative Entscheidungen einbezogen werden sollten. Die Berücksichtigung von Patientenpräferenzen kann die Einhaltung von Behandlung und Pflege verbessern sowie Interventionen verbessern, was wiederum die Lebensqualität von MmD verbessern würde.“
Projektbeschreibung:
Auf dem Weg zur personenzentrierten Betreuung von Menschen mit Demenz: Ermittlung von Pflegepräferenzen bei Menschen mit Demenz und Allgemeinärzten
Das Ziel einer personenzentrierten und hochwertigen Versorgung von Menschen mit Demenz (MmD) erfordert, dass MmD in Entscheidungen im Gesundheitswesen einbezogen wird. Insbesondere für MmD ist eine frühzeitige Teilnahme aufgrund des fortschreitenden Charakters der Krankheit von größter Bedeutung, was zu einem Rückgang der Selbstverantwortung, Selbstbestimmung und Autonomie führt. Die Empfehlungen für die Behandlung und Pflege in den nationalen Leitlinien basieren weitgehend auf klinischen Studien und Expertenmeinungen, wobei der Schwerpunkt auf der Verbesserung der klinischen Parameter liegt. Gewünschte und unerwünschte Patientenpräferenzen und vom Patienten berichtete Ergebnisse (PROs) werden selten berücksichtigt.
Frühere Präferenzstudien ergaben, dass Expertenurteile häufig nicht die subjektiven Präferenzen der betroffenen Patienten widerspiegeln. Um eine personenzentrierte und hochwertige Versorgung zu ermöglichen, müssen die Präferenzen des Patienten berücksichtigt werden. Insbesondere bei MmD ist jedoch wenig über individuelle Pflegepräferenzen bekannt. Ebenso müssen die Präferenzen von Allgemeinärzten ermittelt werden, die als Torhüter für die Bereitstellung einer evidenzbasierten Gesundheitsversorgung fungieren. Wenn sich die Präferenzen von Patienten und Anbietern unterscheiden, ist eine Bereitstellung einer wertorientierten, personenzentrierten Versorgung für MmD unwahrscheinlich. Bis heute ist Forschung, die bei MmD Pflegepräferenzen hervorgerufen hat, selten und die meisten Forschungen haben qualitative Methoden angewendet. Studien, die relevante Aspekte der ambulanten Pflege- und Unterstützungsdienste für MmD auf der Grundlage der angegebenen Präferenzmethoden behandeln, sind rar. Quantitative festgelegte Präferenzmethoden (d. H. Analytischer Hierarchieprozess) werden im Gesundheitswesen zunehmend angewendet, um Präferenzen für eine Reihe von Gesundheitsdiensten zu ermitteln. Derzeit fehlen jedoch Daten für MmD in Deutschland. Das Wissen über die meisten und am wenigsten bevorzugten Entscheidungen ist von wesentlicher Bedeutung und kann die Einhaltung von Behandlungen verbessern sowie Interventionen verbessern, was wiederum die Lebensqualität von MmD verbessern würde. Wenn die Interventionen nicht auf die Vorlieben und Bedürfnisse des Patienten abgestimmt sind, können eine geringe Aufnahme und eine schlechte Einhaltung begrenzte Ressourcen verschwenden.
Mein Projekt zielt darauf ab, die von MmD angegebenen Präferenzen für die Pflege zu ermitteln, ergänzt durch Informationen über die Korrelation mit den von MmD angegebenen Präferenzen für die Pflege von MmD. Ziel ist es, die Bereitstellung einer hochwertigen personenbezogenen Versorgung für MmD zu ermöglichen und eine kosteneffiziente Nutzung knapper Ressourcen im Gesundheitswesen sicherzustellen.
Lebenslauf
| Name | Wiebke Mohr |
| Geburtstag | 28. 12. 1990 |
| Geburtsort | Hamburg |
Education & International Experience |
|
| Seit 09/2020 | Doktorandin, Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE) Site Rostock / Greifswald, AG Hoffmann, Translationale Versorgungsforschung
Projekt: „Patient*innenpräferenzen für person-zentrierte Versorgung von Menschen mit Demenz“ |
| 08/2019 – 08/2020 | Site Start-up & Regulatory Specialist, Syneos Health, Stockholm Klinische Studien Phasen II-III, Market Access Expert-Zertifikat |
| 08/2017 – 06/2019 | MMSc Health Economics, Policy & Management, Karolinska Institut, Stockholm Projekt: „Wie Manager in einer schwedischen Universitätsklinik wertigkeitsorientierte Gesundheitsversorgung verstehen“ |
| 01/2016 – 04/2016 | Auslandsstudium, St. Francis Xavier Universität, Antigonish (CA) |
| 05/2015 – 10/2015 | Praktikantin, Kopenhagen, National Institute of Public Health Projekt: „Kartierung von Gesundheitsinterventionen für ethnische Minderheiten in dänischen Kommunen“ |
| 09/2014 – 06/2017 | Bachelor Studium Public Health, University of Southern Denmark, Odensee Projekt: „Die Inkorporation von traditionellem Wissen in mentale Gesundheit förderne Programme um Suizide unter jugendlichen Inuit in Grönland zu reduzieren“ |
| 10/2010 – 07/2013 | Studium der Rechtswissenschaft, Universität Hamburg |
Honors & Awards |
|
| 11/17-06/19 | Scholarship holder, Bonn, Deutsche Begabtenförderung |
Publications |
|
| Nomura, S., Siesjö, V., Tomson, G., Mohr, W., et al. (2020). Contributions of information and communications technology to future health systems and Universal Health Coverage: application of Japan’s experiences. Health Res Policy. Sys 18, 73 (2020). | |
Other activities |
|
| 09/18-06/20 | Academic Orchestra Royal Institute of Technology, Stockholm, Violist Weekly 3-hours-rehearsals, concerts in major Swedish concert halls |
| 12/17-09/19 | German-Nordic Political Youth Network, Stockholm, Founder & Coord. ‘Willi-Piecyk-Award’ for special European Engagement incl. a prize money of 600€ |
| 08/18 | Nordic WHO Simulation, Copenhagen, Delegate for Germany Topic: Access to Essential Medicines |
| 09/06-12/15 | Landes Jugend Orchester Schleswig Holstein, Kiel, Violist Orchestra for the most talented youth musicians in Schleswig-Holstein |
Link zu Volltext-Lebenslauf im Forschungsinformationssystem der Universität Greifswald
Teilnehmerinnen: Dr. Katja Bär (Breuer-Stiftung) und Wiebke Mohr (Stipendiatin, Breuer-Stiftung)
Bär: Warum interessieren Sie sich für Demenz? Warum forschen Sie gerade zu Demenz?
Mohr: Ich bin bei der Suche nach einem geeigneten Thema für meine Promotion zur Versorgungsforschung im Bereich Demenz gekommen. Vorab hatte ich u.a. ein Angebot aus Heidelberg, um dort im Bereich Global Health zu promovieren. Dabei hätte ich mit vorhandenen Registerdaten aus afrikanischen Ländern arbeiten und hierzu mein Paper schreiben können. Mit dieser Vorstellung – mit Registerdaten und ohne Feldarbeit, also ohne jemals vor Ort gewesen zu sein und die Umstände aus erster Hand kennengelernt zu haben – konnte ich mich nicht anfreunden. Ich finde es schwierig, als Bürgerin eines Landes mit hohem Einkommen über Länder niedrigen-mittleren Einkommens zu schreiben, ohne jemals dort gewesen zu sein und konnte dies nicht mit meinen Prinzipien vereinen.
Über die Ausschreibung der Promotionsstelle des Deutschen Zentrums für Neurodegenerative Erkrankungen e.V. (DZNE) in Greifswald bin ich dann auf das Thema Demenz gestoßen. Ein Thema, das große gesellschaftliche Relevanz hat und aus meiner Sicht nur global zu bekämpfen ist. Die Statistiken zeigen, dass die Demenz bereits heute, aber noch viel stärker in der Zukunft eine riesige Herausforderung darstellt/ darstellen wird, die angegangen werden muss. Hierzu will ich einen Beitrag leisten.
Privat habe ich über beide Großväter, die von einer dementiellen Erkrankung betroffen waren, Erfahrungen gesammelt. Diese waren zum Teil nicht schön und sehr emotional. Einmal hat mein Großvater mich bei einem Besuch im Pflegeheim zunächst nicht erkannt. Als dann nach etwa 10 Minuten das Erkennen wieder gelang, hat mein Opa geweint, weil ihm das Vergessen so bewusst war. Sein Schicksal hat mir sehr weh getan.
Mit meinem Vater spreche ich regelmäßig über meine Forschungsarbeit. Er ist Anästhesist, Psychiater, Sozialmediziner und als Sachgebietsleiter beim sozialpsychiatrischen Dienst in Schleswig tätig und ist von meiner Methodik, die Betroffenen in Gegenüberstellung mit den Expert:innen zu befragen, sehr angetan und hält es für zentral wichtig. Er hält eine Ausweitung der Fragestellung auf andere Krankheiten für richtig.
Bär: Was sind die Schwerpunkte Ihrer Forschung?
Mohr: Ich arbeite mit Patient:innenpräferenzen erhoben durch Methoden der multikriteriellen Entscheidungsfindung, konkret den Analytic Hierarchy Process. Durch diese Methoden lassen sich Präferenzen messen, quantifizieren, gewichten und schließlich in einer Reihenfolge abbilden. Patient:innenpräferenzen sind wichtig, denn durch Kenntnis dieser lässt sich die personen-zentrierte Versorgung von Menschen mit Demenz fördern. Mit Hilfe der AHP Methode, welche eine systematische Entscheidungsfindung unter Berücksichtigung multipler Kriterien unterstützt, ist es möglich, MmD an zukünftigen Versorgungsentscheidungen zu beteiligen und Patient:innenpartizipation zu fördern.
Bär: Wie lautet das Ziel und liegt Ihrer Untersuchung eine bestimmte These zugrunde?
Mohr: Ich möchte eine Grundlage bilden, um Patient:innenpräferenzen zu berücksichtigen und in die Demenzversorgung zu integrieren, und zwar ganz nach dem Motto „Hören Sie auf die Stimme der Betroffenen!“. Für MmD braucht es eine frühe differentielle Diagnose und die Möglichkeit, dass MmD möglichst selbstbestimmt in ihrer eigenen Häuslichkeit und dem dazugehörigen sozialen Umfeld leben, um eine hohe Lebensqualität so lange wie möglich zu erhalten.
Das Projekt PreDemCare hat zum Ziel, die Versorgungspräferenzen aus Perspektive der MmD und Ärzt:innen zu ermitteln, um Patient:innenbeteiligung und personen-zentrierte Versorgung von MmD aktiv zu unterstützen. Konkret geht es um:
- Die Ermittlung der Akzeptanz, Validität und Konsistenz von Versorgungspräferenzen bei MmD anhand des Analytic Hierarchy Process (AHP), sowie
- die Ermittlung der Versorgungspräferenzen bei MmD im Vergleich mit den Versorgungspräferenzen von MmD aus Sicht der behandelnden ÄrztInnen.
Es wird vermutet, dass MmD klare Präferenzen im Hinblick auf eine personen-zentrierte Versorgung aufweisen und diese auch äußern und benennen können. Es wird erwartet, dass der Analytic Hierarchy Process eine geeignete Technik ist, um die Versorgungspräferenzen von Menschen mit Demenz zu ermitteln. Es wird erwartet, dass sich bei diesem Vergleich der Patient:innenpräferenzen aus Sicht der MmD und der Ärzt:innen Unterschiede ergeben. Wir hoffen, dass das in der PreDemCare-Studie entwickelte Präferenz-Messinstrument in der Zukunft Hilfestellung leisten kann, die Kommunikation und damit auch die Beziehung zwischen Ärzt:innen und MmD zu verbessern.
Bär: Welche ersten Erkenntnisse haben Sie bereits gewonnen?
Mohr: Ich habe mit tatkräftiger Unterstützung fantastischer Co-Autor:innen erst vor kurzem mein erstes Paper als Erstautorin im Journal of Alzheimer’s Disease mit dem Titel „Key Intervention Categories to Provide Person-Centered Dementia Care: A Systematic Review of Person-Centered Interventions“, Link: https://pubmed.ncbi.nlm.nih.gov/34542075/) veröffentlicht. Diese systematische Übersichtsarbeit gibt einen Überblick über den aktuellen Stand der veröffentlichten personenzentrierten Interventionsstudien im Indikationsgebiet Demenz und identifiziert neun Schlüsselkategorien zur personenzentrierten Demenzversorgung. Prof. Dr. med. Steffi G. Riedel-Heller sagte uns dazu: „Wiebke Mohr hat ihre Arbeit auf dem Kongress des Deutschen Netzwerkes für Versorgungsforschung (DKVF) vorgestellt. Ich war sehr beeindruckt – sie hat in ihrem Forschungsprojekt tolle Arbeit geleistet.“
Bär: Auf welches Zeitfenster ist Ihre Forschung ausgerichtet?
Mohr: Meine Forschung ist auf 3 Jahre ausgerichtet.
Bär: Was sind die nächsten Schritte?
Mohr: Seit 08.10. hat die Hauptphase meiner Forschungsarbeit begonnen. Dabei sollen 50 assistierte Befragungen mit MmD durchgeführt werden, 38 Befragungen habe ich schon durchgeführt. Nebenbei werden nicht-assistierte Befragungen mit 25 Ärzt:innen durchgeführt, bevor es danach an die Auswertungen der Daten geht. Die Auswertung soll dann u.a. der Frage nachgehen, ob es Unterschiede bei unterschiedlichen (sozialen) Geschlechtern, Altersgruppen, in Abhängigkeit der Schwere der kognitiven Beeinträchtigungen oder der Anzahl an Medikamenten, die eingenommen werden, gibt.
Bär: Welche Auswirkungen auf Ihre Forschungstätigkeit hat Corona mitgebracht?
Mohr: Corona hat meine Arbeit nicht so stark eingeschränkt wie anfangs befürchtet, jedoch natürlich ein bisschen auf meine Stimmung geschlagen. Aufgrund des sehr strengen Hygienekonzepts des DNZE und einer regelmäßigen, engmaschigen Testung und schließlich der Impfung war es mir möglich, zu reisen und Interviews sowie Befragungen durchzuführen. Private soziale Kontakte habe ich jedoch nicht gepflegt, sondern mich freiwillig isoliert. Geholfen hat mir dabei mein Partner, ebenfalls Doktorand (am Leibnizinstitut für Plasmaforschung und Technologie e.V., kurz: INP in Greifswald), so dass wir die Isolation wenigstens in Zweisamkeit gemeinsam durchstehen konnten. Ich freue mich, dass ich unter dem in Greifswald eingesetzten 2G+-Schema, also einer zur Impfung zusätzlichen Testung vor jedem Außendiensteinsatz, noch raus zu meinen Interviewpartner:innen darf und hoffe, dass dies auch für die letzten neun Befragungen möglich bleibt.
Bär: Wie ist das Alfried Krupp Wissenschaftskolleg auf Sie aufmerksam geworden? Wie sind Ihre ersten Erfahrungen mit dem Kolleg?
Mohr: Dass ich beim Alfried Krupp Wissenschaftskolleg aufgenommen wurde, beginnt mit einer der ersten Bekanntschaften nach Ankunft in Greifswald aus Stockholm – einem Mitstipendiaten der Friedrich-Ebert-Stiftung, von der ich vormals gefördert wurde. Ich bin Netzwerkerin! Als mein Mitstipendiat uns beim Umzug geholfen hat, berichtete er mir über das Wissenschaftskolleg. Das hat mich interessiert und so habe ich ihn nach Einladung zu einem Treffen begleitet. Aufgrund meiner interdisziplinären Ausbildung und meiner bisherigen Forschungstätigkeit hat der Wissenschaftsbeirat des Alfried Krupp Wissenschaftskollegs mich – auch mit Freude – in seinen Kreis aufgenommen.
Von der Vielfalt an wissenschaftlichen Themen des Kollegs bin ich total begeistert und empfinde diese Vielfalt als absolute Bereicherung. Das Wissenschaftskolleg stellt regelmäßig Veranstaltungsreihen mit jeweils 4 Vorlesungen auf. Nächstes Thema sind „Lügen“, u.a. Fake News. Alle Themen werden immer aus unterschiedlichen Richtungen beleuchtet. Die Vorlesungen werden von Jungen Kollegiat:innen moderiert, ich werde vsl. eine Veranstaltung am 11. Januar 2021 moderieren.
Liebe Frau Mohr, ich bedanke mich für das Interview; es hat mir wahnsinnig viel Spaß gemacht. Zum einen, weil ich viel gelernt habe und zum anderen, weil Sie ein solch angenehmer Quell positiver Energie sind. Ich freue mich schon heute auf die Fortsetzung unseres Dialogs beim nächsten Eibsee-Meeting im März 2022.

Verbesserung der durch Antikörper vermittelten Amyloid-β-Clearance mit dem agonistischen TREM2-Antikörper 4D9.
Die Alzheimer-Krankheit (AD) ist eine Hauptursache für spät einsetzende Demenz und ist durch abnormale Proteinablagerungen im Gehirn wie Amyloid-β-(Aβ)-Plaques und neurofibrilare Verwicklungen gekennzeichnet. Aβ ist seit Jahrzehnten das Hauptaugenmerk der therapeutischen Forschung, aber erst in den letzten Jahren zeigten Fortschritte bei den Antikörper-Targeting-Strategien einige vielversprechende Ergebnisse. Insbesondere induziert der Anti-Aβ-Antikörper Aducanumab in klinischen Studien eine robuste Aβ-Plaque-Clearance im Gehirn, und klinische Phase-III-Studien deuten vorläufig auf eine Verlangsamung des kognitiven Rückgangs bei einer ausgewählten Gruppe von Patienten hin. Das Risiko unerwünschter Nebenwirkungen aufgrund einer hohen Antikörperdosierung ist jedoch besorgniserregend.
Andere genetische Faktoren, die an der Alzheimer Krankheit beteiligt sind, deuten auf eine herausragende Rolle für Mikroglia hin, die residenten Immunzellen des Gehirns. Eines dieser Gene, TREM2, kodiert für ein Mikroglia-Protein, das an potenziell schützenden Prozessen wie Chemotaxis, Phagozytose, Proliferation und Energiestoffwechsel beteiligt ist. Mikroglia ohne TREM2 können diese Prozesse nicht als Reaktion auf Aβ anpassen, das erforderlich ist, um Aβ angemessen aus dem Gehirn zu entfernen. Die TREM2-Signalübertragung kann daher ein Ziel sein, um die durch Mikroglia vermittelte Aβ-Clearance zu verbessern.
Die Gruppe von Christian Haass hat kürzlich einen Antikörper (4D9) entwickelt, der an TREM2 bindet und die Verfügbarkeit und Signalübertragung von TREM2 erhöht. Es wurde gezeigt, dass die 4D9-Behandlung Amyloid-Plaques in Mäusen reduziert und die Aβ-Phagozytose durch kultivierte Mikroglia verstärkt. Während dieses Promotionsprojekts möchte ich untersuchen, ob der Antikörper 4D9 durch Doppelantikörperbehandlung in einem Mausmodell für die Aβ-Ablagerung synergistisch mit Aducanumab wirken kann. Ich gehe davon aus, dass dies die durch Mikroglia vermittelte Aβ-Plaque-Clearance bei niedrigeren Dosen von Aducanumab verbessern wird. Darüber hinaus möchte ich untersuchen, ob eine duale Behandlung mit 4D9 und Aducanumab das metabolische Versagen von Mikroglia im Kontext der Aβ-Pathologie retten und die molekularen Mechanismen der synergistischen Behandlung von Mikroglia durch transkriptomische, lipidomische und metabolomische Profilerstellung aufklären kann. Da Mikroglia der Schlüssel zur Aufrechterhaltung der Hirnhomöostase sind, sind diese Fragen vor klinischen Tests bei Patienten zu berücksichtigen.
Lebenslauf
| Name | Lis de Weerd |
| Geburtsdatum | 24.06.1994 |
| Geburtsort | Voorburg, Niederlande |
| Seit 08/2020 | Promotionsstudentin, Deutschen Zentrum für Neurodegenerative Erkrankungen in München, AG Haass |
| 01/2019 – 07/2020 | Wissenschaftliche Mitarbeiterin, UK Dementia Research Institute, Cambridge, United Kingdom, AG Mallucci |
| 09/2015 – 02/2018 | Master of Science, Biomedical Sciences, Molecular Neuroscience track University of Amsterdam |
| 01/2017 – 08/2017 | Masters Praktikum Gladstone Institutes, San Francisco, USA, AG GanThesis: „The role of progranulin in microglial phagocytosis of apoptotic cells“. |
| 12/2015 – 07/2016 | Masters Praktikum Smidt Lab, Swammerdam Institute for Life Sciences, Amsterdam, The NetherlandsThesis: „Af9 affects H3K79 methylation during cortical development“. |
| 09/2012 – 07/2015 | Bachelor of Science, Psychobiology, with Honours University of Amsterdam |
| 02/2015 – 06/2015 | Bachelor Praktikum, University of Calgary, Calgary, Canada, AG WilderingThesis: „Lateral lobe control of life-history and memory in Lymnaea stagnalis“ |
Publikationen
Astrocyte Unfolded Protein Response Induces a Specific Reactivity State that Causes Non-Cell-Autonomous Neuronal Degeneration
Smith HL, Freeman OJ, Butcher AJ, Holmqvist S, Humoud I, Schätzl T, Hughes DT, Verity NC, Swinden DP, Hayes J, de Weerd L, Rowitch DH, Franklin RJM, Mallucci GR. Neuron, 2020, 105(5):855-866.e5. https://doi.org/10.1016/j.neuron.2019.12.014.
Linking the ‚why‘ and ‚how‘ of ageing: evidence for somatotropic control of long-term memory function in the pond snail Lymnaea stagnalis de Weerd L, Hermann PM, Wildering WC. J Exp Biol. 2017 Nov 15; 220(pt 22):4088-4094. doi: 10.1242/jeb.167395

„Mich treibt an, etwas zur Heilung von Alzheimer beizutragen.“
Jan Filip Hasecke arbeitet seit Juni 2017 an seiner Promotion in der AG Hoyer im Institut für Physikalische Biologie an der Heinrich-Heine Universität Düsseldorf. Seine Dissertation befasst sich mit der Entwicklung eines neuen Wirkstoffes gegen Alzheimer. „Bei Alzheimer wird angenommen, dass der Auslöser der Krankheit die Verklumpung verschiedener Proteine im Gehirn zu toxischen Aggregaten ist, welche letztlich das Absterben der Neurone auslösen. Um dieses Problem zu lösen entwickle ich in meiner Doktorarbeit eine neue Wirkstoffart: proteolytische Antikörper. Diese besitzen die Spezifität von Antikörpern, jedoch zusätzlich ein katalytisches Zentrum, wie etwa Enzyme. Diese Antikörper sollen Aggregate erkennen und gleichzeitig zerschneiden können und somit unschädlich machen. Das Besondere dabei ist, dass die proteolytischen Antikörper unverändert aus der Reaktion herausgehen und anschließend ungehindert weitere Aggregate abbauen können. Dies verspricht eine enorme Effizienzsteigerung gegenüber bisherigen Antikörpertherapien in klinischen Studien. Besonders gefällt mir an der Arbeit, dass sie aus vielen kleinen Baustellen besteht, wodurch es stetig zu vielen kleinen Teilerfolgen kommt. Vor allem aber ist die Aussicht, tatsächlich etwas an dem Problem der Alzheimer Krankheit verändern zu können, eine treibende Kraft hinter diesem Projekt.“
Projektbeschreibung
Selektion proteolytischer Antikörperfragmente gegen Amyloid-ß via „isolation by Type Restricted Antigen Proteolysis“ (iTRAP)
Bei Proteinmissfaltungskrankheiten wie der Alzheimerschen Krankheit (AD), der Parkinson-Krankheit und Typ 2 Diabetes werden körpereigene Peptide als ursächliche Auslöser angesehen. Durch bisher nicht genau bekannte Stimuli oder Veränderungen im Gleichgewicht der Proteinhomöostase erlangen diese normalerweise harmlosen Peptide die Eigenschaft zur Aggregation. Dadurch verklumpen die Peptide, was zur Anreicherung einer Vielzahl toxischer Aggregate führt, welche resistent gegen die Abbaumechanismen des Körpers sind. In der heutigen Medikamentenentwicklung ist der am häufigsten verfolgte Ansatz zur Entwicklung einer Behandlung die Immuntherapie. Diese Therapien haben folgendes Ziel: Die Aggregate zu eliminieren, indem sie diese markieren und für körpereigene Entsorgungsmechanismen zugänglich machen. Dies soll entweder durch aktive oder passive Immunisierung erreicht werden oder durch die Verabreichung speziell entwickelter Wirkstoffe, welche an die schadhaften Peptide binden sollen. Der am häufigsten genutzte Abbau-Mechanismus ist die Markierung der Aggregate mit spezifischen Antikörpern, welche anschließend durch Mikroglia, den Fresszellen des Gehirns, aufgenommen und abgebaut werden sollen. Leider teilen die verschiedenen Therapieansätze eins oder beide der folgenden Nachteile: I) Die Bildung von Immunkomplexen, welche zur Aktivierung des Immunsystems und einer akuten Entzündungsreaktion im Gehirn führt; II) Der simultane Abbau des therapeutischen Wirkstoffs zusammen mit den gebundenen Zielpeptiden, was eine effiziente Therapie erschwert. In meiner Doktorarbeit soll ein neuer Therapieansatz gegen Proteinmissfaltungskrankheiten vorgestellt und entwickelt werden. Dieser besteht aus hochspezifischen, proteolytisch-aktiven Antikörperderivaten, welche ihr Antigen erkennen und gleichzeitig hydrolysieren (zerscheiden) sollen. Dieser Ansatz könnte seine bisherigen Vorgänger in ihrer Effektivität fundamental übertreffen. Während die konventionellen Antikörperderivate, welche in aktuellen immuntherapeutischen Ansätzen verwendet werden, ein oder ein paar Antigene binden können, bevor sie anschließend zusammen mit ihren gebundenen Antigenen abgebaut werden, könnte ein einziges proteolytisches Antikörperderivat sein erkanntes Antigen zerschneiden, nicht nur binden, und danach noch weitere Antigene abbauen. Wodurch letztlich mehrere tausend Antigene unschädlich gemacht werden können. Um diese proteolytischen Antikörperderivate zu entwickeln, soll die Methode: „Isolation by Type Restricted Antigen Proteolysis (iTRAP)“ etabliert werden, welche ich während meiner Zeit als Masterstudent entworfen habe. Es handelt sich dabei um eine in vitro Microbead Display Methode, welche die Anreicherung proteolytisch-aktiver Antikörperderivate aus großen Antikörper-Genbibliotheken ermöglichen soll. Dabei werden nur jene Antikörperderivate angereichert, die definierte Zielpeptide zerschneiden können. Ein besonderes Feature von iTRAP ist, dass es die Erkennung von post-translationalen Modifikationen und Konformationen innerhalb der Zielpeptide durch die proteolytisch-aktiven Antikörperderivate ermöglichen sollte. Darüberhinaus sollten die Antikörperderivate, durch den Selektionsprozess bedingt, die Fähigkeit zur Selbstfaltung und ausreichende Stabilität im reduzierenden, chemischen Milieu besitzen, um eine intrazelluläre Anwendung zu ermöglichen. Intrazelluläre Anwendungen waren bislang mit konventionellen Antikörpern undenkbar, da diese durch das intrazelluläre, reduzierende Milieu ihre dreidimensionale Struktur verlieren würden, da ihre Disulfidbrücken zerstört werden würden. Aus diesen Gründen könnte iTRAP die Entwicklung einer neuen Generation von Therapeutika gegen Amyloid-β , Tau, IAPP, Huntingtin und andere krankheitsbezogene Peptide ermöglichen.
Lebenslauf
| Name | Jan Filip Tristan Hasecke |
| Geburtsdatum | 24.08.1992 |
| Seit 2017 | Promotionsstudent im Institut für Physikalische Biologie, AG Hoyer. Heinrich-Heine-Universität Düsseldorf |
| 2014 – 2017 | Master of Science in Biologie, Schwerpunkt Molecular BioMedicine, Heinrich-Heine-Universität, Düsseldorf (Gesamtnote: 1,1) |
| Masterarbeit: „Aggregation mechanism of amyloid-β studied by an artificial dimer“ bei Dr. Wolfgang Hoyer & Prof. Dr. Henrike Heise (Note: 1,0) | |
| 2011 – 2014 | Bachelor of Science in Biologie, Schwerpunkt Molecular BioMedicine, Heinrich-Heine-Universität, Düsseldorf (Gesamtnote 1,3) |
| Bachelorarbeit: „Characterization of the aggregation properties of a covalently linked amyloid-β dimer“ bei Dr. Wolfgang Hoyer & Prof. Dr. Henrike Heise (Note: 1,0) | |
| Auszeichnungen | Dreifacher Deutschlandstipendiat |

Nadine Mylonas arbeitet seit Juli 2016 an der Graduate School for Systemic Neurosciences (GSN) und dort in der Fachgruppe von Prof. Dr. Harald Steiner, Deutsches Zentrum für Neurodegenerative Erkrankungen e.V. (DZNE), München. Im Fokus ihrer Arbeit liegt die γ-Sekretase. Hierbei handelt es sich um ein Enzymkomplex, welches bei der Produktion von Beta-Amyloid eine Schlüsselrolle übernimmt. Ablagerungen dieses Proteins stellen ein Hauptmerkmal der Alzheimerschen Krankheit dar. „Das Ziel meiner Doktorarbeit ist es nun zu entschlüsseln, wie die γ-Sekretase zu spaltende Proteine erkennt und schließlich teilt. Ein präzises Verständnis des Erkennungs- und Spaltungsmechanismus ist essentiell, um die Entwicklung und Verbesserung von Medikamenten sowie präventiven Strategien für Alzheimer voranzutreiben. Es ist überaus spannend, immer wieder neue Hypothesen aufzustellen und diese zu überprüfen, um diesen komplexen Mechanismus so besser zu verstehen. Ich hoffe sehr, dass ich mit meiner Arbeit einen Beitrag für die Erforschung der Alzheimerschen Krankheit leisten kann.
Projektbeschreibung
Alzheimer ist eine neurodegenerative Erkrankung, die 1906 erstmals von Alois Alzheimer beschrieben wurde. Die Erkrankung zeichnet sich durch Ablagerungen der beiden Proteine Beta-Amyloid (sog. Aβ-Plaques) und Tau (sog. Fibrillen) im Gehirn eines an Alzheimer erkrankten Patienten aus. Im Verlauf der Krankheit ist die normale Funktion der Nervenzellen zunehmend gestört und letztlich sterben die Zellen, sowie die Verbindungen zwischen den Nervenzellen ab. Betroffene leiden zunehmend unter Gedächtnis-, Orientierungs- und Sprachstörungen, wie auch unter einer Veränderung der Persönlichkeit.
Im Fokus meiner Doktorarbeit liegt die γ-Sekretase, ein Enzymkomplex welcher bei der Produktion von Beta-Amyloid eine Schlüsselrolle übernimmt. Bisher ist eine Vielzahl von Proteinen (Substrate) beschrieben worden die von diesem Enzym geschnitten werden können. Trotz großer Fortschritte, wie beispielsweise der Aufklärung der Struktur der γ-Sekretase, ist immer noch unklar wie die Sekretase ihre Substrate erkennt und letztendlich schneidet. Es wird vermutet, dass eine gewisse Flexibilität der Substrate wichtig ist, damit diese das aktive Zentrum der Sekretase erreichen und schließlich von dieser geschnitten werden können. Das Ziel meiner Doktorarbeit ist es (kinetische) Parameter für die Bindung und Spaltung ausgewählter Substrate untereinander zu vergleichen um so den Erkennungs- und Spaltungsmechanismus der γ-Sekretase zu entschlüsseln. Ein zentraler Aspekt ist dabei der Einfluss struktureller Eigenschaften der verschiedenen Substrate auf diese Parameter. Die genaue Analyse des Erkennungs- und Spaltungsmechanismus von γ-Sekretase Substraten hilft uns zu verstehen wie die Substrate, genauer welche Eigenschaften, wichtig für die Erkennung und die Prozessierung durch die γ-Sekretase sind. Zusätzlich werde ich in meiner Doktorarbeit die Bedeutung der Lipide für die Substraterkennung und -spaltung untersuchen, da nachgewiesen werden konnte, dass verschiedene Lipidklassen die Aktivität der γ-Sekretase beeinflussen können. Zudem wurde gezeigt, dass die Lipidzusammensetzung der Membran durch die Ernährung beeinflusst werden kann. Dies könnte wiederum die Spaltung der Substrate durch die γ-Sekretase beeinflussen. Unklar ist jedoch wie die Erkennung und Spaltung der Substrate durch die Lipide beeinflusst wird. Um die Rolle der Lipidumgebung für die Erkennung und Spaltung der Substrate besser zu verstehen, werde ich (kinetische) Parameter der γ-Sekretase in Modelmembranen mit unterschiedlicher Lipidkomposition bestimmen. Ein präzises Verständnis des Erkennungs- und Spaltungsmechanismus von γ-Sekretase-Substraten ist essentiell um die Entwicklung und Verbesserung von Medikamenten, sowie präventiven Strategien für Alzheimer voranzutreiben.
Lebenslauf
| Name | Nadine Tamara Mylonas |
| Geburtsdatum | 14.06.1991 |
| seit 2016 | Promotionsstudent an der „Graduate School for Systemic Neurosciences” (GSN), Arbeitsgruppe von Prof. Dr. Harald Steiner, Deutsches Zentrum für Neurodegenerative Erkrankungen e.V. (DZNE), München |
| 2015 – 2016 | Praktikum bei Danone Nutricia Research, Utrecht |
| 2013 – 2015 | Master of Science in Human- und Molekularbiologie, Universität des Saarlandes, Saarbrücken |
| 2012 – 2013 | Erasmus Semester, Universität Sheffield, Sheffield |
| 2010 – 2013 | Bachelor of Science in Biologie, Ludwig-Maximilians-Universität, München |

Projektbeschreibung
Der Forschungsschwerpunkt meiner Doktorarbeit ist der molekulare Mechanismus der frontotemporalen Lobärdegeneration (FTLD). FTLD gehört wie die Alzheimer Erkrankung zu den neurodegenerativen Erkrankungen und ist zudem die zweithäufigste Form präseniler Demenz. Wie auch bei Alzheimer leiden betroffene Patienten unter der Bildung von Proteinablagerungen im Gehirn, welche, aufgrund der betroffenen Hirnbereiche, vor allem zu Sprachstörungen und auch zu Verhaltensauffälligkeiten und Persönlichkeitsänderungen führen können. FTLD kann sowohl sporadisch als auch in einer genetisch vererbten Variante auftreten. Um sowohl eine sichere Diagnostik als auch eine Therapie der Krankheit zu ermöglichen, ist es wichtig, dass wir zuerst die molekularen Mechanismen verstehen, die die Krankheit verursachen. Die Krankheits-assoziierten Gene könnten dabei ein entscheidender Schlüssel sein.
Eines dieser krankheitsspezifischen Gene ist Progranulin. FTLD relevante vererbte oder spontan erworbene Veränderungen in diesem Gen führen häufig zu einer starken Reduzierung des Progranulin Proteins (PGRN). PGRN scheint eine wichtige Rolle bei Entzündungsprozessen, der Wundheilung und dem Zellwachstum zu spielen. Es wurde außerdem beschrieben, dass ein kompletter Verlust des Proteins im Körper zu einer lysosomalen Speicherkrankheit, der neuronalen Ceroid-Lipofuszinose, führt. Zudem wurde festgestellt, dass auch in Mausmodellen der FTLD die Expression von lysosomalen Proteinen verändert ist. Deshalb wird vermutet, dass PGRN zusätzlich zu den bereits bekannten Funktionen, eine wichtige Aufgabe bei dem Abbau zellulärer Proteine hat. In meinem Projekt werde ich daher den Einfluss von PGRN auf die Aktivität lysosomaler Enzyme untersuchen. Zudem werde ich die funktionellen Konsequenzen von zwei bisher unbekannten Mutationen im GRN Gen untersuchen.
Lebenslauf
| Name | Anika Reifschneider |
| Geburtstort | Neuss |
| Geburtsdatum | 19.07.1991 |
| Seit 09/2016 | Promotion “Cellular and molecular mechanisms of Parkinson’s and Alzheimer’s disease and frontotemporal lateral degeneration”
Deutsches Zentrum für Neurodegenerative Erkrankungen e.V., München AG Haass, Supervisor: Dr. Anja Capell |
| 10/2014-07/2016 | Master of Science in medizinischer Biotechnologie
Technische Universität Berlin |
| 09/2015-05/2016 | Masterarbeit: ”Characterization of elements that skew Cas9 induced double-stranded DNA break repair towards homology directed repair”
Oslo University Hospital, Department of Microbiology |
| 01/2014-03/2014 | Bachelor’s Thesis: “Aptamer based detection of thrombin and streptavidin” (grade: A+)
Technische Universität Berlin, Germany |
| 10/2011-09/2014 | Bachelor of Science in Biotechnologie
Technische Universität Berlin, Germany |
| 07/2010-08/2011 | Freiwilliges soziales Jahr/Entwicklungspolitischer Dienst im Ausland, Bolivien
Deutsches Rotes Kreuz in Hessen Volunta gGmbH |

Projektbeschreibung
Investigating the role of aberrant protein-protein interactions in familial ALS pathogenesis using iPSC-derived motor neurons
Amyotrophic lateral sclerosis (ALS) is a fatal neurodegenerative disorder that selectively affects motor neurons. Approximately 5 to 10 % of cases are familial (fALS) and result from inherited genetic mutations, such as those affecting the gene Fused in Sarcoma (FUS). The FUS protein is a crucial regulator of multiple cellular functions, including stress granule (SG) formation as well as RNA binding and processing. Aggregates of FUS are a hallmark of FUS-ALS, but the role of these aggregates in disease pathogenesis is not clear. This question remains unresolved because the majority of studies have used cellular models incapable of recapitulating the complex biology of motor neurons (MNs). As a result, no therapeutics are available to prevent or slow ALS pathogenesis. Induced pluripotent stem cells (iPSCs) provide a revolutionary approach to model ALS because they can be differentiated into a theoretically limitless number of patient-specific MNs.
In order to investigate ALS in vitro, our lab previously used CRISPR/Cas9-mediated gene editing to generate isogenic WT and P525L FUS-eGFP iPSCs. In line with existing reports, P525L FUS showed preferential abnormal cytoplasmic localization, and high content imaging performed on arsenite-stressed cells linked the mutation to altered SG dynamics. Using the GFP sequence as an affinity tag, we performed a preliminary pull down experiment on iPSC-derived MNs to explore FUS interactors, and identified protein partners interacting differentially with WT and P525L FUS. Because some of the detected proteins have been associated with ALS when mutated, we consider this as a strong clue that something relevant for the disease is happening at this level, and speculate that such interactions are integral to the induction of FUS-ALS. We propose to further investigate protein-protein interactions in this model to identify which players may be crucial for disease pathogenesis.
To determine if ALS pathology is induced via gain- or loss-of-function, we will either knock down or overexpress these proteins in iPSC-derived MNs, and evaluate the impact on ALS pathological phenotypes. Our hope is to shed some light on the mechanisms involved in disease pathogenesis, thereby facilitating the discovery of novel therapeutic approaches. Since pathological aggregation of proteins is a key feature of ALS, – and FUS inclusions have been reported also in sporadic cases, indicating a common pathological denominator – it may be possible, in the future, to develop these findings into therapeutics for most ALS patients.
Lebenslauf
| Name | Lara Marrone |
| Date of Birth | 14.03.1991 |
| since 2016 | Center for Regenerative Therapies TU Dresden (CRTD), PreDoc |
| 2013 – 2015 | Master of Science Degree in Regenerative Biology and Medicine at Center for Regenerative Therapies TU Dresden (CRTD), Dresden, Germany |
| 2010 – 2013 | Bachelor of Science Degree in Medical and Pharmaceutical Biotechnology at the Vita-Salute San Raffaele University, Milan, Italy |
Publikationen
Oxygen Tension Within the Neurogenic Niche Regulates Dopaminergic Neurogenesis in the Developing Midbrain
Wagenführ L, Meyer AK, Marrone L, Storch A., Stem Cells Dev. 2016 Jan 7, (doi: 10.1089/scd.2015.0214).
Brain oxygen tension controls the expansion of outer subventricular zone-like basal progenitors in the developing mouse brain
Wagenführ L, Meyer AK, Braunschweig L, Marrone L, Storch A., Development. 2015 Sep 1;142(17):2904-15, (doi: 10.1242/dev.121939)
Adoptive T-cell therapy in the treatment of viral and opportunistic fungal infections
Mancini N, Marrone L, Clementi N, Sautto G, Clementi M, Burioni R., Future Microbiology, Vol. 10, No. 4 , Pages 665-682, (doi: 10.2217/fmb.14.122)

Projektbeschreibung
FUNCTIONAL ANALYSIS OF PHOSPHOLIPASE D3 (PLD3) IN ALZHEIMER´S DISEASE
Alzheimer´s disease (AD) is the most common form of progressive dementia in the elderly, for which several genetic risk factors have been described. Previously, a whole-exome sequencing study identified that a rare coding variant in the phospholipase D3 (PLD3) gene confers a two-fold risk factor in the development of AD, affecting the turnover and cleavage products of the Amyloid Precursor Protein (APP). PLD3 contains two conserved HKD motifs. As a result, it has been classified as a member of the phospholipase D family, together with the well characterized phospholipases D1 and D2. However, to date, no canonical activity or substrate has been described for PLD3.
Our group has described PLD3 as a transmembrane protein transported throughout the secretory and endocytic pathway. In early endosomal compartments, PLD3 co-localizes with APP. PLD3 is then proteolytically processed to a soluble form in acidic compartments to finally reach lysosomes. Our data indicate that PLD3 transport to lysosomes is mediated via the endosomal sorting complex required for transport (ESCRT) where previous ubiquitination of lysine residues is required for sorting into intraluminal vesicles (ILVs).
In brains derived from Pld3-deficient mice no changes of APP full length levels nor its cleavage products, including amyloid beta (Aß), were found. However, microgliosis in the dentate gyrus of the hippocampus together with a depression-like behavior was observed. As part of this project our Pld3 KO mouse will be bred into an established AD mouse model (Pld3-/-5xFAD). We believe that the AD-related phenotypes of this well described mouse strain will help us to decipher the effect of the absence of Pld3 on the turnover, transport and processing of APP, by performing cell biology and biochemical approaches, e.g. culture of primary neurons and immunohistochemistry. Previous data have shown that APP is also ubiquitinated and transported to ILVs via de ESCRT pathway to further be degraded in lysosomes, therefore, ubiquitination and MVB-dependent sorting of Pld3 in cell lines and primary neurons will be also investigated.
We hypothesize that Pld3 affects the sorting of APP in late endosomal-/lysosomal compartments and thereby its proteolytic cleavage and degradation is affected leading to an accumulation of Aß plaques and further increasing the probability to develop AD.
Lebenslauf
| Name | Adriana Carolina González |
| Date of Birth | 12.05.1988 |
| since 2015 | PhD student. Functional characterization of new membrane-associated lysosomal proteins. Institute of Biochemistry. Unit of Molecular Cell Biology and Transgenic Research. Christian Albrecht Universität zu Kiel, Germany |
| 2012 – 2015 | Master of Science Degree in Molecular Cell Biology and Neurobiology, Department of Human Biology and Human Genetics, University of Kaiserslautern, Germany |
| 2005 – 2010 | Diploma in Biology at Simon Bolivar University, Caracas, Venezuela |

Projektbeschreibung
Die amyotrophe Lateralsklerose (ALS) ist eine Erkrankung, die bei Erwachsenen auftritt und durch fortschreitende Lähmungen aufgrund der Degeneration von Motoneuronen (MN) gekennzeichnet ist. Obwohl die meisten Fälle sporadisch auftreten, sind etwa 10 % familiär bedingt und werden durch genetische Mutationen in Genen wie SOD1, FUS und C9ORF72 verursacht. Transgene Mäuse, die mutiertes SOD1 exprimieren, rekapitulieren die charakteristischen Merkmale der ALS-Pathologie, einschließlich MN-Degeneration, mitochondrialer Dysfunktion, Aggregation des SOD1-Proteins, fortschreitender Lähmung und verkürzter Lebenserwartung. Da Mitochondrien eine entscheidende Rolle für das Überleben von Zellen spielen, haben viele Gruppen versucht, MNs vor Degeneration zu schützen, indem sie die Mitochondrienfunktion vor der ALS-Pathologie bewahren. Die Lähmung bei ALS-Patienten ist jedoch nicht das Ergebnis einer Degeneration der Nervenfasern, sondern einer Degeneration der neuromuskulären Verbindungen (NMJs), die später zum Verlust der Nervenfasern führt. Folglich werden alle Therapien, die nur darauf abzielen, das Überleben der MN zu erhalten, wahrscheinlich keine Wirkung auf die ALS-Pathogenese haben. Stattdessen ist es wichtig, sich auf die Erhaltung der NMJ-Struktur und -Funktion zu konzentrieren.
iPSCs sind in der Lage, unser Verständnis der ALS zu revolutionieren und die Identifizierung neuer Therapeutika zu ermöglichen. Durch Reprogrammierung können iPSCs von einem ALS-Patienten mit einem spezifischen Phänotyp und Genotyp gewonnen werden. Aus iPSC abgeleitete ALS-MNs können dann dazu verwendet werden, die Krankheitspathogenese des Spenderpatienten zu rekapitulieren. Mithilfe von Genkorrekturen wurden isogene iPSCs von ALS-Patienten mit mutiertem SOD1 erzeugt und gezeigt, dass aus iPSCs abgeleitete MNs von ALS-Patienten ALS-relevante Phänotypen in vitro rekapitulieren. Da der Verlust der NMJ die Hauptursache für die Lähmung bei ALS-Patienten ist, argumentieren wir, dass eine skalierbare Plattform für die Modellierung der NMJ-Dysfunktion unter Verwendung von iPSCs ein leistungsfähiges Instrument zur Identifizierung neuer ALS-Therapeutika wäre.
Das Projekt zielt darauf ab, eine Plattformtechnologie zu entwickeln und zu validieren, die NMJ-basierte ALS-Modelle für das Screening von Wirkstoffen ermöglicht. Zusammen mit der Forschungsgruppe von PD Dr. Dr. Andreas Hermann haben wir eine Prototypplatte entworfen und stellen diese her, die MNs und Myotubes in einem hochgradig reproduzierbaren Muster verbindet, das skalierbar und mit Hochdurchsatzscreening (HTS) kompatibel ist. Wir schlagen vor, dieses Werkzeug zu entwickeln und es zu verwenden, um ein erstes Modell der ALS auf der Grundlage der NMJ-Funktion zu erstellen. Wir beabsichtigen, Elektroden in unsere Platten einzubauen, um HTS der NMJ-Funktion zu ermöglichen. Wir haben bereits iPSC-Linien von ALS-Patienten mit Mutationen in FUS und C9ORF72 erzeugt und führen derzeit eine Genkorrektur dieser Mutationen durch, um isogene iPSC-Linien zu erzeugen. Wir schlagen vor, diese aus diesen isogenen iPSC-Linien differenzierten MNs zu verwenden, um mit Hilfe unserer neuartigen Platten die Auswirkungen von ALS-Mutationen auf die Degeneration der NMJ zu testen, was direkt mit dem ersten Ereignis vergleichbar ist, das bei Patienten zu Lähmungen führt. Schließlich schlagen wir vor, ein Pilot-Screening mit 1000 bekannten Wirkstoffen durchzuführen, um sowohl die Verwendung unserer Platten als auch die NMJ-Degeneration als Screening-Plattform zu validieren. Die Ergebnisse dieses Projekts könnten die ALS-Forschung erleichtern und Einblicke in neue Therapien geben.
Lebenslauf
| Name | Jessica Bellmann |
| Geburtsdatum | 17.11.1989 |
| seit 2016 | Promotionsstudent am DFG Research Center for Regenerative Therapies Dresden (CRTD), Cluster of Excellence Department iPS Cells and Neurodegenerative Disease (Dr. Jared Sterneckert) |
| 2013 – 2015 | Master of Science in „Regenerative Biology and Medicine“, TU Dresden |
| 2009 – 2012 | Bachelor of Science in „Biologie“, TU Braunschweig |

Projektbeschreibung
Mein Forschungsschwerpunkt sind die molekularen Mechanismen der Frontotemporalen Demenz (FTD) und Amyotrophen Lateralsklerose (ALS). Diese neurodegenerativen Erkrankungen sind eng verwandt mit der Alzheimerschen Krankheit. Da jedoch andere Nervenzellen vom Zelltod betroffen sind, kommt es anders als bei Alzheimer nicht zum Gedächtnisverlust, sondern zu einer fortschreitenden Veränderung der Persönlichkeit, des Sprachvermögens oder der Muskulatur. FTD und ALS sind bislang unheilbar und führen nach einigen Jahren unweigerlich zum Tode. Auf molekularer Ebene zeichnen sich beide Erkrankungen durch eine abnorme Umverteilung und Aggregation bestimmter Proteine aus; diese Proteinaggregate können sowohl im Zytosol als auch im Zellkern von Nervenzellen vorkommen. Zwei Proteine, die in den Proteinaggregaten gefunden wurden, sind TDP-43 (TAR DNA-binding protein of 43 kDa) und FUS (Fused in sarcoma). Beide Proteine erfüllen vielfältige Aufgaben in Zellen und es ist bekannt, dass Mutationen im TDP-43- und FUS-Gen erbliche Formen der ALS und gelegentlich auch FTD verursachen können. Wie es zur pathologischen Umverteilung und Aggregation von TDP-43 und FUS kommt und wie dies zum Krankheitsbild der FTD und ALS führt, konnte bislang nicht geklärt werden. Meine Doktorarbeit widmet sich dem Export von TDP-43 und FUS aus dem Zellkern. Im Normalzustand sind beide Proteine hauptsächlich im Zellkern von Zellen lokalisiert. Kleine Mengen an TDP-43 und FUS können aber auch in zytosolischen Fortsätzen detektiert werden, was auf den Export beider Proteine aus dem Zellkern ins Zytosol hindeutet. Über welche Transportwege TDP-43 und FUS aus dem Zellkern exportiert werden, ist noch unerforscht. Das Ziel meiner Doktorarbeit ist es, mit Hilfe von zell- und molekularbiologischen Untersuchungen herausfinden, wie der Kernexport von TDP-43 und FUS in gesunden Zellen abläuft, um dann eventuelle Export-Veränderungen im Zusammenhang mit FTD und ALS feststellen zu können. Ich hoffe, dass meine Arbeit uns neue Einblicke in die molekularen Mechanismen der FTD und ALS gewährt und einen kleinen Beitrag zum besseren Verständnis dieser Krankheitsbilder leistet.
Lebenslauf
| Name | Helena Ederle |
| Geburtsdatum | 19.01.1987 |
| seit 07/2018 | Sanofi-Aventis Deutschland GmbH |
| 09/2014 – 06/2018 | Promotion mit Erlangung eines GSN (Graduate School of Systemic Neurosciences) Ph.D.-Titels am BioMedizinischen Centrum der Ludwig-Maximilians-Universtität München (Arbeitsgruppe Dr. Dorothee Dormann) |
| 2011 – 2014 | Master of Science (M.Sc.) in Molecular Biosciences (Schwerpunkt Neurowissenschaften) an der Ruprecht-Karls-Universität Heidelberg |
| 2013 – 2014 | Auslandsaufenthalt für die Masterarbeit am Cold Spring Harbor Laboratory, New York, USA |
| 2007 – 2010 | Bachelor of Science (B.Sc.) in Biology (Schwerpunkt Physiologie) an der Universität Ulm |
Publikationen
- Ederle & Dormann: TDP-43 and FUS en route from the nucleus to the Cytoplasm.
FEBS Letter, 2017
- Khosravi et al.: Cytoplasmic poly-GA aggregates impair nuclear import of TDP-43 in C9orf72 ALS/FTLD.
Hum Mol Genetics, 2017
- Ederle et al.: Nuclear egress of TDP-43 and FUS occurs independently of Exportin-1/CRM1.
Sci Reports, 2018
- Hock et al.: Hypertonic Stress Causes Cytoplasmic Translocation of Neuronal, but Not Astrocytic, FUS due to Impaired Transportin Function. Cell Reports, 2018

Projektbeschreibung
Primary progressive aphasia (PPA) is a clinical label for a heterogeneous group of diseases and syndromes in which a neurodegenerative disorder presents with aphasic symptoms in the initial stages. To date, PPA research has focused on brain imaging, neuropsychology, and biochemical markers of the disease and virtually nothing is known about the neurophysiology of PPA. Simple language-based tasks will be administered to gain insight into the neurophysiology of language processing in PPA patients with the target of identifying different spatio-temporal signatures of language processing in the various degenerative diseases that cause PPA. The absence or degradation of signal components leads to specific disabilities (=symptoms) in language processing. The project will use the non-invasive techniques of event-related magnetoencephalography (MEG) and electroencephalography (EEG). This neurophysiology project will be embedded as a sub-project in a large prospective study of PPA (n=200) with a multi-disciplinary team investigating neuropsychology and imaging (MRI and PET) of PPA. The specific aim of this project is to create an electrophysiological landscape of the various forms of PPA. The deeper understanding of language processing can inform mechanistic understanding of PPA subtypes and offers potential to identify biomarkers that could differentiate between the different pathologies that can cause PPA both for diagnosis and monitoring symptomatic interventions. Furthermore, detailed information about the spatio-temporal pattern of language processing in PPA is fundamental for the future development of treatment options like speech therapy and might lead to treatment approaches with transcranial magnetic stimulation (TMS).
Lebenslauf
| Name | Daniel Preiß |
| Geburtsdatum | 06.10.1987 |
| seit 04/2014 | Promotionsstudent am Deutschen Zentrum für Neurodegenerative Erkrankungen in Magdeburg, AG Hirnplastizität & Neurodegeneration (Prof. Dr. Peter Nestor) |
| 10/2011 – 03/2014 | Master of Science in „Integrative Neuroscience“, Otto-von-Guericke Universität Magdeburg |
| Masterarbeit: A Feasibility Study of Repetitive Transcranial Magnetic Stimulation to Treat Language Fluency Impairment in Primary Progressive Aphasia related to Alzheimer’s Disease bei Prof. Dr. Peter Nestor | |
| 10/2008 – 09/2011 | Bachelor of Science in “Biologie“ (Schwerpunkt: Neuro- und Verhaltensbiologie), Georg-August Universität Göttingen |
| Bachelorarbeit: Metrische Unterschiede an Skelettelementen der unteren Extremitäten im recht-links Vergleich bei Dr. Susanne Hummel |

Projektbeschreibung
The role of chromatin readers in memory formation and neurodegeneration
Alzheimer’s disease (AD) is the most common age associated form of dementia. Yet, the pathology of the disease is to date not well understood on a molecular level. While some cases of AD have a genetic underpinning, the majority of the AD cases (95%) is sporadic. The most realistic approach in the short term is a treatment to delay the onset and thus improve life quality for the affected and cut treatment costs significantly. Notably, it is commonly accepted that late onset AD is a result of variable combination of genetic and environmental risk factors. This puts epigenetic mechanisms in the spotlight for the search for novel treatments, since here environmental factors are translated into molecular alterations. The precise mechanisms how epigenetic processes control memory function are however only beginning to emerge. A finding important for my PHD project is that alterations in histone 4 at lysine 12 actetylation (H4K12ac) were linked to the pathogenesis of Alzheimer’s disease (Peleg et al, 2010). How H4K12ac is regulated during memory formation is however not understood. Moreover, it is completely unclear by which signals neuronal activity is coupled to altered epigenetic gene-expression in the nucleus. In preliminary experiments we performed a proteomic screen using SILAC technology to identify proteins that specifically bind to H4K12ac in neurons. We found a number of proteins that that are known chromatin readers, hence proteins that read the epigenetic code for example by binding to specific epigenetic modifications which initiates subsequent events that control gene-expression. The most interesting proteins were the so called Bromodomain containing proteins (BRD), BRD2 and BRD4. The function of BRD proteins in the adult brain is so far completely unknown but in other cellular systems it has been shown that BRD2 and BRD4 specifically bind to H4K12ac. Further preliminary data shows that pharmacological inhibition of BRD2/4 binding to H4K12ac in the adult hippocampus enhances memory function in mice. The host lab has generated mice that allow the conditional deletion of BRD2 in mice (Brd2 cKO mice) and Brd4 cKO mice will shortly be available. In my PhD thesis I will analyse cognitive function in Brd2/4 cKO mice. To this end I will generate mice that lack Brd2/4 in excitatory or inhibitory neurons of the adult brain and subject these animals to behavior testing including the analysis of memory function (fear conditioning, water maze, T-maze, Y-maze, novel object recognition), anxiety (Elevated plus maze, open field) and sensory motor gating function (pre pulse inhibition of startle response). I will combine the behavior data with a molecular analysis of gene-expression and chromatin plasticity. During my PhD work I want to analyse Brd2/4 levels in AD, study the role of Brd2/4 in memory formation and AD. But also investigate the cellular pathways regulated by Brd2/4 during cognition, as well as the chromatin-distribution of Brd2. And further I want to analyse Brd2-dependent chromatin marks and gene-expression. In conclusion my PhD thesis is based on solid preliminary evidence and will address for the first time to role of chromatin readers in memory formation. Peleg S, Sananbenesi F, Zovoilis A, Burkhardt S, Bahari-Java S, Agis-Balboa RC, Cota P, Wittnam J, Gogul-Doering A, Opitz L, Salinas-Riester G, Dettenhofer M, KAng H, Farinelli L, Chen W, Fischer A (2010) Altered histone acetylation is associated with age-dependent memory impairment in mice. Science 328: 753-756
Lebenslauf
| Name | Hendrik Urbanke |
| Geburtsdatum | 09.06.1987 in Nürnberg |
| seit 01/2014 | Promotionsstudent am Deutschen Zentrum für Neurodegenerative Erkrankungen Göttingen, AG Epigenetik neurodegenerativer Erkrankungen (Prof. Dr. Andre Fischer) |
| 10/2011 – 10/2013 | Master of Science “Developmental, Neuro, und Behavioural Biology”, Georg-August-Universität Göttingen, mit Auszeichung |
| 06/2012-11/2012 | Hilfswissenschaftlicher Mitarbeiter, Erforschung von Lateralität und operanter Konditionierung in D. melanogaster |
| 10/2008 – 09/2011 | Bachelor of Science “Allgemeine Biologie” mit Schwerpunkt Neurobiologie und Morphologie, Georg-August-Universität Göttingen |
Publikationen
Stilling RM, Rönicke R, Benito E, Urbanke H, Capece V, Burkhardt S, Bahari-Javan S, Barth J, Sananbenesi F, Schütz AL, Dyczkowski J, Martinez-Hernandez A, Kerimoglu C, Dent SY, Bonn S, Reymann KG, Fischer A (2014). K-Lysine acetyltransferase 2a regulates a hippocampal gene expression network linked to memory formation. The EMBO Journal July 2014

Projektbeschreibung
Funktionale Analyse der Phosphorylierun von LRRK2 in Morbus Parkinson mittels humaner induzierter pluripotenter Stammzellen (iPSCs)
In einer immer älter werdenden Gesellschaft steigt die Anzahl von Menschen mit neurodegenerativen Erkrankung wie Morbus Parkinson (MP) rapide an. Parkinson ist die zweithäufigste neurodegenerative Krankheit bei Erwachsenen: Einer von tausend Europäern über dem Lebensalter von sechzig erkrankt an diesem Leiden. Bei Parkinsonpatienten sterben über den Zeitraum von mehreren Jahrzehnten die Nervenzellen in der substantia nigra pars compacta, ein für den Bewegungsapparat entscheidender Teil im Gehirn, ab, die normalerweise den Neurotransmitter Dopamin produzieren dopaminerge Neuronen im Mittelhirn, mDA Neurone). Bisher erhältliche Medikamente können allerdings nur symptomatische Linderung verschaffen, indem sie den Verlust von Dopamin ausgleichen. Derzeit sind demnach keine Wirkstoffe bekannt, die die Krankheitsursache direkt angehen und verhindern können. Daher hat die Entwicklung neuer Substanzen höchste Priorität. Wir schlagen als innovative Therapiemöglichkeit die Modulierung der Aktivität der Leucine-rich repeat kinase (LRRK2) vor. Mutationen im LRRK2-Gen sind die am häufigsten nachgewiesene genetische Ursache für MP, allerdings ist der exakte molekulare Mechanismus bisher unbekannt. Obwohl LRRK2 in den letzten Jahren im Fokus der Parkinsonforschung steht, ist nur wenig über die Funktion des Gens in Erfahrung gebracht worden. Das LRRK2-Protein wird in Nervenzellen produziert, es kann mit einer Vielzahl von anderen Proteinen interagieren und es besitzt eine enzymatische Kinase-Aktivität, katalysiert also Prozesse innerhalb einer Zelle. Bereits vor einiger Zeit hingegen ist als grundlegendes Prinzip entdeckt worden, wie Zellen ihre Proteine regulieren und an- bzw. ausschalten können, um so die verschiedenen Prozesse innerhalb einer Zelle zu steuern. Zellen erreichen dies unter anderem durch Modifikation von bestimmten Stellen im Protein, indem z. B. eine Phosphatgruppe an eine Aminosäure gekoppelt wird Phosphorylierung. Für das LRRK2-Protein wurden über dreißig dieser Stellen festgestellt, und konsistent mit dieser Idee findet man bei Patienten mit MP-verursachenden LRRK2 Mutationen abnormale Modifikationen am LRRK2-Protein, die die enzymatische Aktivität von LRRK2 verändern. Diese abnormalen Phosphorylierungen führen dazu, dass Nervenzellen im Zellkultur- und Tiermodell neuronale Phänotypen zeigen und absterben. Modifiziert man hingegen diese abnormalen Modifikationen ist es möglich, die Nervenzellen vor Zerstörung zu retten. Daher ist es wahrscheinlich, dass die beobachteten Veränderungen von LRRK2 auch beim Patienten eine wichtige Rolle in der Krankheitsentstehung Pathogenese von MP spielen. Die exakte Funktion für die meisten der bekannten Phosphorylierungsstellen bei LRRK2 ist unklar, insbesondere bei den im Patienten betroffenen mDA Neuronen. Um besser zu verstehen, wie die Phosphorylierung von LRRK2 und die MP-Pathologie mechanistisch verbunden sind, haben wir ein in vitro Zellmodell entwickelt, welches ein frühes Stadium der MP-Pathogenese im Patienten darstellt. In diesem Modell erzeugen wir mDA Neuronen aus Stammzellen, die wir von Parkinsonpatienten hergeleitet haben (induzierte pluripotente Stammzellen, iPSCs). Die so erzeugten Zellen werden in verschiedenen Methoden dazu genutzt, um den Einfluss und die Funktion der Phosphorylierungsstellen unter verschiedenen Bedingungen wie Stress oder genetische Faktoren zu testen.
Lebenslauf
| Name | Michael Glatza |
| Geburtsdatum | 16.12.1985 |
| seit 2013 | Promotionsstudent am Max-Planck-Institut für molekulare Biomedizin Münster, Department Cell and Developmental Biology (Prof. Schöler) |
| 2009 – 2013 | Master of Science in „Molekulare Biomedizin“, WWU Münster und Karolinska Institutet Stockholm |
| 2006 – 2009 | Bachelor of Science in „Biowissenschaften“, WWU Münster und ETH Zürich |
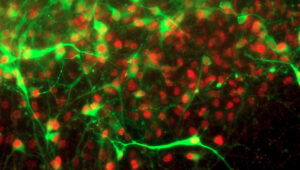
mDA Neuronen, die aus patientenspezifischen iPSCs differenziert wurden, sind die Grundlage für unser in-vitro-Zellkulturmodell von MP
Bedeutung und Ziele
In den kommenden Jahren verfolgen wir mit diesem Projekt mehrere Ziele. Kurzfristig wird unser Projekt die Auswirkungen von alternativen Phosphorylierungszuständen von LRRK2 auf die Pathogenese von MP in humanen mDA Neuronen aufzeigen. Dieses Wissen wird uns helfen zu verstehen, wie die enzymatische Aktivität von LRRK2 innerhalb einer Zelle kontrolliert wird und wie diese Regulation in MP involviert ist. Zukünftig könnten diese Phosphorylierungsstellen nützliche Biomarker während klinischer Studien sein, in denen neuartige Medikamente auf ihre Wirksamkeit hin getestet werden. Mittelfristig werden wir in der Lage sein, weitere Elemente des Netzwerks zu identifizieren, mit denen LRRK2 interagiert und reguliert wird. Die Entzifferung dieser Regulatoren und Mechanismen wird klären, wie krankheitsverursachende Mutationen die physiologische Funktion von LRRK2 stören, und inwiefern die Modulierung der enzymatischen Aktivität von LRRK2 einen therapeutischen Nutzen für den Patienten haben könnte. Als Langzeitziel wollen wir neue Moleküle entdecken, die diese spezifischen Phosphorylierungsstellen modifizieren, um damit eine Behandlung für Patienten zu ermöglichen. Die Regulation von Kinasen wie LRRK2 ist eine bestens etablierte Therapiestrategie, die bereits sehr erfolgreich in der Behandlung von Krebs angewendet wird. Daher ist es abzusehen, dass unser Projekt zu neuen potentiellen Zielen für die Entwicklung von Medikamenten gegen MP führen kann.
Publikationen
Peer-Reviewed Articles
Derivation and expansion using only small molecules of human neural progenitors for neurodegenerative disease modeling
Peter Reinhardt, Michael Glatza, et al.
PLoS ONE 8.3 (2013) e59252. 2013
Genetic Correction of a LRRK2 Mutation in Human iPSCs Links Parkinsonian Neurodegeneration to ERK-Dependent Changes in Gene Expression
Peter Reinhardt, Benjamin Schmid, Lena F Burbulla, David C Schöndorf, Lydia Wagner, Michael Glatza, et al.
Cell Stem Cell 12.3 (Mar. 2013) pp. 354–367. 2013
Discovery of Inhibitors of Microglial Neurotoxicity Acting Through Multiple Mechanisms Using a Stem- Cell-Based Phenotypic Assay
Susanne Höing, York Rudhard, Peter Reinhardt, Michael Glatza, et al.
Cell Stem Cell (Oct. 2012) pp. 1–13. Elsevier Inc., 2012
Non-Peer-Reviewed Articles
Michael Glatza
Edinburgh University Science Magazine 12, 2012
Susanne Höing, Michael Glatza, Jared Lynn Sterneckert, Hans Robert Schöler
Laborwelt 4, 2012

Das Stipendium von Katharine Miller wurde ermöglicht durch eine großzügige Zuwendung der Alfred Dollwet Stiftung, Mainz.
Projektbeschreibung
TDP-43 and TranslationalControl in FTLD, ALS and Related Neurodegenerative Disorders
Frontotemporal Lobar Degeneration (FTLD) is the second most common cause of presenile onset dementia after Alzheimer’s disease. Recent groundbreaking work supports a major role for the RNA-binding protein (RBP) TDP-43 in FTLD and other major age-related neurological diseases, including Amyotrophic Lateral Sclerosis (ALS) and Alzheimer’s disease. TDP-43 is a ubiquitously expressed, largely nuclear protein in healthy cells. In disease, aberrant localization and aggregation of TDP-43 protein are found in affected neurons 1 and disease-causing mutations in TDP-43 have been identified in both FTLD and ALS patients (reviewed in 2). Nevertheless, how TDP-43 contributes to disease remains unclear. TDP-43’s relocalization from the nucleus to the cytoplasm in disease affected neurons raises a fundamental, unanswered question: is disease due to a loss of nuclear function, gain of cytoplasmic function, or a combination of the two? Since TDP-43 exhibits nuclear/cytoplasmic shuttling ability, it is likely that TDP-43 has important cytoplasmic functions, as has been described for other nuclear RBPs, such as Sex-lethal 3. Indeed, recent genome-wide studies 4,5 revealed that TDP-43 binding sites are also found in mRNA 3’ UTRs, a key region for cytoplasmic regulation of translation by RBPs. Taken together, available data support the idea that TDP-43 may regulate translation of a subset of mRNAs and suggest that aberrant translational regulation by TDP-43 could play an important role in promoting neurodegeneration and disease. Here I propose to investigate potential cytoplasmic functions of TDP-43 in mRNA-specific translational control in neurons. In my thesis project I aim specifically to:
- Identify mRNAs whose translation is regulated by TDP-43 in neuronal cells
- Determine which mRNAs are bona fide in vivo translational targets of TDP-43 in mice
- Analyze the translational control mechanism used by TDP-43 on its neuronal targets
To achieve these aims I will use a combination of genome-wide and molecular approaches, many of which I have already previously established during my diploma thesis. By first searching for candidates in neuronal cell culture using polysome profiling, I will be able to easily screen for neuronal mRNA targets and rule out false positives. Subsequent focused studies in mouse will allow validation of specific targets in vivo and exploration of the relevance of targets to disease. Through a combination of cell-based assays and cell-free in vitro translation methods, insight into the underlying molecular mechanism will be obtained.
Through this study, I hope to elucidate TDP-43’s effects on translation of specific neuronal mRNAs. I expect my findings to greatly enhance our understanding of TDP-43’s neuronal functions, both in health and disease. Moreover, this approach has the potential to identify new targets for therapeutic development to treat these devastating diseases.
Lebenslauf
| Name | Katharine Miller |
| Geburtsort | Wauwatosa, WI, USA |
| Geburtsdatum | 05. April 1984 |
| seit 2011 | Doktorandin zum Thema „Molecular biological research of translational control involved in neurological disorders.“ am Duncan Laboratory der Universitätsklinik Hamburg-Eppendorf, Zentrum für Molekulare Neurobiologie Hamburg |
| 2010 – 2011 | Arbeit an der Diplom-/Masterarbeit an der Universitätsklinik Hamburg, Zentrum für Molekulare Neurobiologie Hamburg, Thema: „Molecular biological research of translational control involved in neurological disorders.“ |
| 2008 | Bachelor of Arts mit dem Fokus auf „Molecular Biology and Genetics“ an der Northwestern University in Evanston, Illinois |
| 2006 – 2010 | Labortechnikerin am Dallos Laboratory an der Northwestern University, School of Communication in Evanston, Illinois, USA |
| 2004-2006 | Arbeitsstudie zu „Molecular biological research on protein interactions in the outer hair cells of mammalian cochlea“ im Dallos Laboratory an der Northwestern University, School of Communication in Evanston, Illinois |
| 2002-2004 | Assistentin für die Kollektion und Organisation von Daten zur Kortisonausschüttung als Reaktion auf Stress im Mineka Laboratory an der Northwestern University, Weinberg College of Arts and Sciences in Evanston, Illinois |
Publikationen
1. CEACAM16 is associated with the Tectorial Membrane and Deafness Locus DFNA4.
Jing Zheng*, Katharine K. Miller*, Tao Yang, P. Kevin Legan, Richard Goodyear, Guy Richardson, MaryAnn Cheatham, Richard J.H. Smith, Peter Dallos. Proc Natl Acad Sci, U.S A. 2011 Mar 8;108(10):4218-23. Epub 2011 Feb 22
*indicates co-first authorship
2. Interaction Between the Motor Protein Prestin and the Transporter Protein Vapa.
Soma Sengupta*, Katharine K. Miller*, MaryAnn Cheatham, Peter Dallos, Jing Zheng. Biochim Biophys Acta, volume 1803 No. 7. pp 796-804. July 2010.
*indicates co-first authorship
3. Interaction between CFTR and Prestin (SLC26A5).
Kazuaki Homma, Katharine K. Miller, Charles T. Anderson, Soma Sengupta, Guo-Guang Du, Salvador Aguinaga, MaryAnn Cheatham, Peter Dallos, Jing Zheng. Biochim Biophys Acta, volume 1798
No. 6. pp. 1029-40. June 2010.
4. EHD4 and CDH23 Are Interacting Partners in Cochlear Hair Cells.
Soma Sengupta, Manju George, Katharine K. Miller, Khurram Naik, Jonathan Chou, MaryAnn Cheatham, Peter Dallos, Mayumi Naramura, Hamid Band, and Jing Zheng. The
Journal of Biological Chemistry, volume 284 No. 30. pp 20121-20129. 24 July 2009
5. Identifying Components of the Hair-Cell Interactome Involved in Cochlear Amplification.
Jing Zheng, Charles T. Anderson, Katharine K. Miller, MaryAnn Cheatham, Peter Dallos. BMC Genomics, 25 March 2009.

Lebenslauf
| Name | Katrin Strecker |
| Geburtsort | Heilbronn-Neckargartach, Deutschland |
| Geburtsdatum | 20. August 1985 |
| seit 10/2010 | Promotion bei Prof. Dr. Dr.h.c. Christian Haass am Adolf-Butenandt-Institut und DZNE, Ludwig-Maximilians-Universität München. |
| 09/2009 – 06/2010 | Masterarbeit zum Thema „Investigation of the neuronal functions of the kinase S6KII in Drosophila melanogaster” bei Prof. Dr. Thomas Raabe, Note: 1,0. |
| 02/2009 – 06/2009 | Praktikum an der Universität Edinburgh/Schottland zum Thema “How do dendritic cells multitask in the face of stimulation by diverse pathogens?” |
| 10/2008 – 07/2010 | Aufbaustudium der Biomedizin an der Julius-Maximilians-Universität Würzburg, Abschluss: Master of Science (Note: 1,0). |
| 04/2008 – 07/2008 | Bachelorarbeit zum Thema: “The impact of differential surface glycosylation on the functions of dendritic cells” bei Prof. Dr. Manfred Lutz, Note: 1,0. |
| 10/2005 – 07/2008 | Grundständiges Studium der Biomedizin an der Julius-Maximilians-Universität Würzburg, Abschluss: Bachelor of Sciences (Note: 1,6). |

Projektbeschreibung
PARKIN as a possible link between neurodegeneration and cancer
Mutationen im Parkin-Gen sind für die Mehrzahl der autosomal rezessiven Parkinson-Krankheiten verantwortlich. Parkin ist eine E3-Ubiquitin-Ligase mit einer breiten neuroprotektiven Aktivität. Es kann die mitochondriale Integrität aufrechterhalten und den Zelltod unter verschiedenen Stressbedingungen verhindern. Kürzlich wurde gezeigt, dass Parkin an der mitochondrialen Qualitätskontrolle beteiligt ist, indem es die Beseitigung beschädigter Mitochondrien durch Mitophagie anregt.
In den letzten Jahren wurde Parkin auch mit Krebs in Verbindung gebracht, da Mutationen im Parkin-Gen bei mehreren Krebsarten gefunden wurden. Die Krebsstudien deuten auf eine Rolle von Parkin als Tumorsuppressor-Gen (TSG) hin. Im Gegensatz dazu zeigen Studien aus der Parkin-Forschung eine anti-apoptotische Wirkung von Parkin unter Stressbedingungen. Diese beiden beobachteten Aktivitäten von Parkin – TSG-Aktivität auf der einen und neuroprotektive Aktivität auf der anderen Seite – veranlassten uns zu der Frage, ob an diesen scheinbar gegensätzlichen Aktivitäten von Parkin gemeinsame oder unterschiedliche Signalwege beteiligt sind. Eine Möglichkeit wäre, dass die beiden Aktivitäten durch unterschiedliche Arten der Ubiquitinierung von Zielmolekülen reguliert werden, da Parkin bekanntermaßen eine E3-Ubiquitin-Ligase ist.
Die erwarteten Ergebnisse dieses Projekts könnten dazu beitragen, die Mechanismen zu verstehen, die mit zwei häufigen Krankheiten von großer medizinischer Bedeutung – Neurodegeneration und Krebs – zusammenhängen. Darüber hinaus könnte ein Einblick in die Funktion von Parkin für die Entwicklung neuer therapeutischer Strategien für die Parkinson-Krankheit von Interesse sein.
Lebenslauf
| Name | Maria Patra |
| Geburtsort | Landshut, Deutschland |
| Geburtsdatum | 2. Mai 1986 |
| seit 09/2015 | Scientist bei MorphoSys AG |
| 12/2010-07/2015 | Doktorandin am Adolf-Butenandt-Institut, Lehrstuhl für Stoffwechselbiochemie, AG Parkinson´s Disease bei PD Dr. Dr. Konstanze Winklhofer (IMPRS-LS PhD Programm) |
| 04/2010-09/2010 | Masterarbeit am Institut für Virologie der TU München bei Prof. Dr. Volker Bruss: „Construction and characterization of an RFP-labeled envelope protein of HBV“ (Note: 1,0) |
| 06/2008-08/2008 | Bachelorarbeit am Insitut für Virologie der TU München bei PD Dr. Ingo Drexler: „Construction of recombinant MVA for differential antigen expression“ (Note: 1,0) |
| 08/2007-09/2007 | Praktikum am Department of Pathology der University of Melbourne zum Thema „β- und γ-Sekretase in der Alzheimer-Erkrankung“ |
| 2005-2010 | Studium der Biochemie an der TU München |

Projektbeschreibung
Entwicklung von gentherapeutischen Werkzeugen, welche zielgerichtet neuronale Zellzyklusaktivierung hemmen sollen – ein kritisches Ereignis in der pathologischen Kaskade von neuronalem Zelltod bei der Alzheimerschen Erkrankung
Neurodegenerative Erkrankungen wie die Alzheimersche Erkrankung gehören noch immer zu den ganz großen Herausforderungen in der Wissenschaft. Sie stellen eine enorme sozioökonomische Belastung mit einem hohen medizinischen Aufwand dar.
Die Alzheimersche Erkrankung ist die häufigste neurodegenerative Erkrankung des Menschen und zugleich die häufigste Ursache einer Demenzerkrankung im Alter. Die Ursachen dieser schweren Erkrankung sind bis zum heutigen Zeitpunkt noch nicht geklärt und es gibt keine effektive Prävention bzw. Therapiestrategie. Die klinischen Symptome und die Neurodegeneration werden durch die Bildung von extrazellulären senilen Plaques, überwiegend bestehend aus dem Peptid Amyloid-ß (Aß), einem Spaltprodukt des Amyloid-Vorläuferproteins (APP) hervorgerufen. Neben den Plaques stellen die neurofibrillären Bündel oder auch Tangles das zweite Charakteristikum dar. Hauptbestandteil der Tangles ist das Mikrotubuli-assoziierte Protein Tau.
Diese pathologischen Strukturen führen u.a. zu einem Absterben umliegender Neuronen. Noch vor jeder fibrillären Ablagerung, sind lösliche molekulare Aggregate des Amyloid-ß (z. B. Dimere und Oligomere) wahrscheinliche Auslöser von pathologische Kaskaden, die zu neurodegenerativen Prozessen führen. Bei der Alzheimerschen Krankheit und anderen neurodegenerativen Prozessen wird in der Literatur beschrieben, dass die Neuronen eine verstärkte Expression von Zellzyklus-Proteinen (Cyklin-abhängige Kinasen (CDKs), Cycline, Proliferationsmarker, Cdk-Inhibitoren (CDKis)) aufweisen. Das ist ein Hinweis für einen Wiedereintritt der differenzierten Neuronen in den Zellzyklus, dieser kann jedoch nicht vollständig durchlaufen werden und es kommt zur Apoptose. Vermutlich treiben verschieden mitogene Faktoren eine Aktivierung von Signaltransduktionskaskaden an, verbunden mit einer Störung der Zellzyklusaktivierung. Es wurde bereits beschrieben, dass auch Amyloid-ß Oligomere mögliche Auslöser für einen Wiedereintritt der Neuronen in den Zellzyklus sein können und somit diese an neuronalen Zelltod beteiligt sind. Die Kontrolle des Zellzykluses erfolgt durch Cyclin-abhängigen Kinasen, die wichtige Funktionen in den einzelnen Zellzyklus-Phasen einnehmen. Zudem erfolgt die Regulation der CDK/Cyclin-Aktivität über eine Reihe von Phosphorylierungs- oder Dephosphorylierungsereignissen und durch die Wirkung von CDK-Inhibitoren. Diese Inhibitoren binden und hemmen den Cdk-Cyclin-Komplex. Es ist bekannt, dass Cyklin-abhängige Kinasen wie CDK4, CDK6 und CDK1 an pathologischen Phosphorylierungsprozessen beteilligt sind und die CDK4 auch eine wichtige Rolle bei der Induktion von neuronaler Apoptose spielt. Das Konzept dieses Projektes basiert auf der Hemmung des Wiedereintritts der Neuronen in den Zellzyklus durch eine Runterregulierung der CDK1-, CDK4- & CDK6- Aktivität mittels transgener Expression ihrer physiologischen Inhibitoren. Es wurde bereits durch transgene Ansätze gezeigt, dass die gezielte Überexpression von p16INK4a in in vivo Modellen der Neurodegeneration, neuroprotektive Effekte erzielt. Unser Ziel in diesem Projekt ist es, ein neues gentherapeutisches Werkzeug zu entwickeln, welches eine sichere, langanhaltende, neuronspezifische und regulierbare Transgenexpression mit neuroprotektiven Hintergrund garantiert. Als Basis für das Genshuttlesystem sollen nicht integrierende lentivirale Vektoren verwendet werden. Die zellspezifische Expression der CDKis werden unter Kontrolle eines neuronspezifischen Promotors stehen. Der Vektor kann je nach Expressionslevel des Transgens weiter modifiziert werden. Ist eine Erhöhung der Expression erforderlich, so kann eine verstärkte Promotoraktivität z. B. über Fusion mit einem CMV- (Cytomegalievirus) Enhancer (Hybrid-Promoter) oder Einbau des WPRE (woodchuck hepatitis virus posttranscriptional regulatory element) erreicht werden. Die Regulierung der Transgenexpression soll durch das Tet-on/off-System gesteuert werden. Die Blut-Hirnschranke stellt eine bedeutende Hürde für eine vektorvermittelte Gentherapie in das Gehirn dar. Diese Hürde soll u.a. mittels convection-enhanced-delivery (CED) überwunden werden. Die neuentwickelten Vektoren, sollen in verschiedenen transgenen Mäusen mit amyloid-ß Pathology getestet und dabei die CDK4 und CDK6 Aktivität spezifisch in Neuronen reguliert werden. Die Effekte dieser gentherapeutischen Anwendung sollen u.a. im Hypocampus und im Neocortex mittels verschiedenen Markern (neuronal, microglia, astrolglia) quantifiziert und analysiert werden.
Lebenslauf
| Name | Pia Glöckner |
| Geburtsort | Schkeuditz, Deutschland |
| Geburtsdatum | 31.Juli 1980 |
| seit 09/2007 | Wissenschaftliche Mitarbeiterin bei Prof. T. Arendt am Paul-Flechsig-Institut für Hirnforschung der Universität Leipzig |
| 11/2006-12/2006 | Praktikum an der Zhejiang Universität in Hangzhou/China |
| 01/2006-08/2006 | Wissenschaftliche Mitarbeiterin bei Prof. A. Bader am Biotechnologisch-Biomedizinischem Zentrum der Universität Leipzig |
| 10/1999-10/2005 | Studium der Biologie an der Universität Leipzig |
| Projektarbeit: „Molecular insights into speciation in the Agrilus viridis-complex and the genus Trachys” (Colepotera: Buprestidae)“ bei Prof. M. Schlegel | |
| Diplomarbeit: „Investigation of incorporation with a 3’acyl nucleotide by the Klenow-Fragment of the E.coli- DNA-Polymerase I and preparing a evolutiv method for the improvement of the Polymerase-Activity” bei Prof. M. Schlegel |
Publikationen
Rohn S., Suttkus A., Glöckner P., Arendt T., Ueberham U.: Antibody-coupled polyethylenimine conjugates can specifically deliver p16INK4a DNA into neuronal cells and protect neurons from neurodegeneration. in preparation
Pavlica S., Schmitmeier S., Glöckner P., Pisconeri A., Peinemann F., Krohn K., Siegmundschulz M., Laera S., Favia P., De Bartolo L., Bader A.: Effect of native and NH(3) plasmafunctionalized polymeric membranes on the gene expression profiles of primary hepatocytes. J Tissue Eng Regen Med. 2011 Jul 13. doi: 10.1002/term.453.
Diekmann S., Glöckner P., Bader A.: The influence of different cultivation conditions on the metabolic functionality of encapsulated primary hepatocytes. Int J Artif Organs. 30(3), 192-8, 2007.
Bernhard D., Fritzsch G., Glöckner P., Wurst C.: “Molecular insights into speciation in the Agrilus viridis-complex and the genus Trachys” (Colepotera: Buprestidae) Eur. J. Entomol. 102(4), 599-605, 2005.

Projektbeschreibung
Untersuchung von mit frontotemporaler Demenz assoziierter Risikofaktoren
Frontotemporale lobare Degeneration (FTLD) ist die zweithäufigste Ursache von Demenz bei Menschen unter 65 Jahren. Die Krankheit äußert sich u.a. in einer Veränderung der Persönlichkeit und des zwischenmenschlichen Verhaltens und wird durch einen fortschreitenden Verlust der Neuronen im frontalen und temporalen Kortex charakterisiert.
FTLD-TDP, die größte Untergruppe von FTLD, weist Ubiquitin-immunreaktive neuronale cytoplasmatische oder nukleäre Einschlüsse auf, die als Hauptkomponente das TAR DNA-Bindeprotein-43 (TDP-43) enthalten.
- Identifikation von Arzneimitteln, welche die Expression von Progranulin erhöhen und somit dem Haploinsuffizienz-Phänotyp von FTLD-Patienten mit Progranulin-Mutationen entgegenwirken
- Charakterisierung des Risikofaktors TMEM106B und Untersuchung des Zusammenhangs zwischen TMEM106B und Progranulin in FTLD
Lebenslauf
| Name | Christina Lang |
| Geburtsort | Landsberg am Lech |
| Geburtsdatum | 28. Oktober 1983 |
| seit 09/2010 | Graduiertenprogramm „Neurodegenerative Disease Research“ im SFB 596, LMU München, Promotion bei Prof. Dr. Christian Haass und Dr. Anja Capell, Adolf-Butenandt Institut und DZNE, München |
| 10/2009- 05/2010 | Masterarbeit bei PD Birgit Luber, Institut für Molekulare Pathologie, Technische Universität München |
| 02/2009 – 07/2009 | Auslandssemester an der Victoria University of Wellington, Neuseeland; DAAD-Stipendium und TUM-Stipendium |
| 10/2007 – 05/2010 | Masterstudium der Molekularen Biotechnologie, Technische Universität München; Abschluss: Master of Science (Note: 1,2) |
| 08/2008 – 09/2009 | freiwilliges Industriepraktikum bei Roche Diagnostics, Penzberg |
| 10/2004 – 09/2007 | Bachelorstudium der Molekularen Biotechnologie, Technische Universität München, Abschluss: Bachelor of Science (Note: 1,5) |

Projektbeschreibung
Die Blut-Hirn-Schranke und Morbus Alzheimer
Morbus Alzheimer (AD, „Alzheimer’s disease“) ist eine neurodegenerative Erkrankung und tritt vorwiegend im Alter auf. AD ist durch eine Abnahme der Gehirn- und Gedächtnisleistung gekennzeichnet und wird durch den Verlust von Neuronen, neurofibrillären Versteifungen und extrazellulären Ablagerungen des Amyloid-β (Aβ) Peptids zu senilen Plaques in betroffenen Gehirnregionen charakterisiert. Bis heute wird eine zentrale Rolle des Aβ1-42 Peptids bei der Alzheimer Pathogenese angenommen. Bisher wurden viele Bemühungen für die Elimination des Peptids unternommen, einer ist der Transport über die Blut-Hirn-Schranke (BBB, „blood brain barrier“). Die BBB grenzt das zirkulierende Blut vom Gehirn ab und spielt dabei eine wichtige Rolle bei der Aufrechterhaltung der Homöostase des Gehirns. Desweiteren ist sie essentiell für die Versorgung des Gehirns mit Nährstoffen und verhindert den Transport vieler toxischer, aber auch therapeutischer Substanzen. Am Aufbau der Blut-Hirn-Schranke sind Endothelzellen, die feste Zell-Zell-Verbindungen (sogenannte „Tight Junctions“), sowie Astrozyten und Perizyten beteiligt. Die Endothelzellen exprimieren eine Vielzahl von spezialisierten Transportern und Rezeptoren, die für die Nährstoffversorgung des Gehirns wichtig sind. Bis heute wurden auch verschiedene Proteine identifiziert, die am Transport von Aβ Peptiden über die BBB beteiligt sind. Eines dieser Proteine ist das P-Glycoprotein (P-gp). P-gp ist ein ATP-abhängiger Transporter, der u.a. eine große Rolle bei der Elimination von Medikamenten aus dem Gehirn spielt. In einem Teilprojekt soll die Rolle von P-gp am Transport von Aβ über die BBB detaillierter untersucht werden, um weitere mögliche Ansätze für die Behandlung von AD zu entwickeln. Neben der Eliminierung von Aβ aus dem Gehirn ist ein weiterer Ansatz die Veränderung der Aβ1-42 Produktion im Gehirn. 2001 wurde gezeigt, dass NSAIDs (nichtsteroidalen Antirheumatika, „non steroidal anti inflammatory drugs“) die Aktivität der -Sekretase modulieren und selektiv die Produktion von Aβ1-42 senken können. Allerdings können diese Substanzen die BBB nicht überwinden. Kürzlich konnte aber gezeigt werden, dass nicht-permeable Substanzen, die an HSA („human serum albumin“) Nanopartikel gebunden sind, über die BBB transportiert werden können. Mit Hilfe dieser Nanopartikel könnte es möglich sein dass NSAIDs die BBB überwinden und die Produktion von Aβ1-42 in Alzheimer Patienten spezifisch modulieren können.
Lebenslauf
| Name | Sabrina Tschickart |
| Geburtsort | Mainz, Deutschland |
| Geburtsdatum | 31. Januar 1984 |
| seit 01/2010 | Doktorandin an der Johannes Gutenberg-Universität Mainz, Institut für Pathobiochemie in der Arbeitsgruppe „Molekulare Neurodegeneration“ von Prof. Dr. Claus Pietrzik |
| 01/2009 – 09/2009 | Diplomarbeit bei Boehringer Ingelheim Pharma GmbH & Co.KG, Abteilung ZNS Forschung, Gruppe ZNS Forschung III, Thema: „Untersuchungen zur Funktion der PDE9 in neuronalen Systemen“ mit Dr. Cornelia Dorner-Ciossek (Note: 1,1) |
| 08/2007 – 01/2008 | Austauschstudentin an der Århus Universität in Dänemark |
| 04/2004 – 09/2009 | Studium der Biologie Johannes Gutenberg-Universität Mainz |
| 04/2003 – 03/2004 | Freiwilliges Soziales Jahr: Deutsches Rotes Kreuz, Einsatzstelle: DRK Schmerzzentrum Mainz, Tätigkeit im Pflegedienst |

Projektbeschreibung
Strukturelle und funktionelle Analyse von Signalpeptidpeptidase-ähnlicher (SPPL) Protease-vermittelter Intramembranproteolyse
Die Alzheimer-Krankheit (AK) ist die häufigste Form der senilen Demenz und ist charakterisiert durch einen progressiven und irreversiblen Verlust von Erinnerung und kognitiver Leistungsfähigkeit. Charakteristisch für die Erkrankung sind amyloide Plaques und Neurofibrillen in Hirnproben von betroffenen Patienten. Amyloidplaques sind Aggregate der amyloid β-Peptide (Aβ) und die Entstehung dieser löst nach derzeitigem Kenntnisstand eine Kaskade molekularer Ereignisse aus, die letztlich zu neuronalem Zelltod und der klinischen Manifestierung der AK führen. Aβ-Peptide werden durch schrittweise Proteolyse des amyloid precursor proteins (APP) generiert. Zunächst wird APP von der β-secretase BACE hydrolysiert und in einem Schritt werden Aβ-Peptide durch Intramembranprotelyse freigesetzt. Dieser Schritt wird vom so genannten γ-Sekretase-Komplex katalysiert. Preseniline (PS) sind die aktiven Proteine in diesem Komplex und gehören zu einer Familie von Intramembranproteolyse-vermittelnden Aspartylproteasen. Diese tragen ein GxGD-Motiv in ihrem aktiven Zentrum und umfassen außer den Presenilinen auch die Signalpeptidpeptidase (SPP) und SPP-ähnliche Proteasen (SPPLs). Angesichts der Rolle der γ-Sekretase bei der Entstehung der AK stellt diese Proteasefamile ein viel versprechendes therapeutisches Ziel dar. Im Zuge dieser Arbeit soll die atomare Struktur von humanem SPPL3 mittels Röntgenkristallographie aufgeklärt werden. Dies wird Einblicke in katalytische und mechanistische Eigenschaften dieser Proteasefamilie ermöglichen und angesichts der Homologie zu PS wird dies besonders für die Wirkstoffentwicklung von großer Bedeutung sein. Außerdem sollen mittels Mutagenese die Determinanten der Substratselektivität dieser Familie untersucht werden. Sehr auffällig ist außerdem, dass PS, anders als SPP/SPPLs, nicht endoproteolysiert wird und diese Diskrepanz wird experimentell untersucht. Diese Arbeit wird damit Einblicke in die grundsätzlichen Prinzipien der Intramembranproteolyse der GxGD Aspartylproteasen ermöglichen und wird damit zu unserem heutigen Verständnis der anfänglichen molekularen Ereignis der Entstehung von Morbus Alzheimer erheblich beitragen.
Lebenslauf
| Name | Matthias Voss |
| Geburtsort | Kiel, Deutschland |
| Geburtsdatum | 09. Dezember 1984 |
| seit 10/2009 | Graduiertenprogramm “Protein Dynamics in Health and Disease“ des Elitenetzwerks Bayern |
| seit 04/2009 | Graduiertenprogramm “Neurodegenerative Disease Research“ im SFB 596, Ludwig-Maximilians-Universität München |
| seit 04/2009 | Doktorand/wiss. Mitarbeiter, Prof. Dr. Christian Haass und PD Dr. Regina Fluhrer, Adolf-Butenandt-Institut und DZNE – München |
| 2008-2009 | Diplomarbeit, Prof. Dr. Ottmar Janßen, Institut für Immunology, Universitätsklinikum Schleswig-Holstein (UK-SH), Campus Kiel, CAU zu Kiel (Note: “ausgezeichnet“/0.7) |
| 2005 – 2009 | Diplomstudiengang “Biochemie und Molekularbiologie“, Christian-Albrechts-Universität zu Kiel (Durschnittsnote: “ausgezeichnet“/0.7) |
Publikationen
Voss, M., Künzel, U., Higel, F., Kuhn, PH., Colombo, A., Fukumori, A., Haug-Kröper, M., Klier, B., Grammer, G., Seidl, A., Schröder, B., Obst, R., Steiner, H., Lichtenthaler, SF., Haass, C., Fluhrer, R. (2014). Shedding of glycan-modifying enzymes by signal peptide peptidase-like 3 (SPPL3) regulates cellular N-glycosylation. The EMBO Journal.
Lettau, M., Pieper, J., Gerneth, A., Lengl-Janßen, B., Voss, M., Linkermann, A., Schmidt, H., Gelhaus, C., Leippe, M., Kabelitz, D., Janssen, O. The adapter protein Nck: Role of individual SH3 and SH2 binding modules for protein interactions in T lymphocytes. Eingereicht.
Schwarz, N., Pruessmeyer, J., Hess, M.F., Pantaler, E., Windoffer, R., Voss, M., Sarabi, A., Sechi, A., Uhlig, S., Ludwig, A.: Sequential steps of leukocyte recruitment via the transmembrane chemokine CX3CL1. In Revision.
Voss, M.*, Lettau, M.*, Janssen, O. (2009). Identification of SH3 domain interaction partners of human FasL (CD178) by phage display screening. BMC Immunol 10, 53.
Voss, M.*, Lettau, M.*, Janssen, O. (2008). Posttranslational regulation of FasL function. Cell Commun Signal 6, 11.
Projektbeschreibung
Untersuchung der Expression von BACE1 während der Entwicklung und im Zusammenhang mit der Alzheimer Pathologie
Die Alzheimer-Erkrankung ist weltweit die häufigste neurodegenerative Erkrankung im Alter und wird durch eine fortschreitende und irreversible Demenz charakterisiert. Frühe Symptome umfassen den Verlust des Kurzzeit-Gedächtnisses sowie subtile Verhaltensänderungen. Im weiteren Verlauf kommt es schließlich zur Beeinträchtigung der Sprache, kontrollierten Bewegung und Wahrnehmung. Histopathologisch manifestiert sich die Krankheit u.a. durch den Verlust von Neuronen und abnormalen Proteinablagerungen im Gehirn von Patienten. Diese Ablagerungen bestehen entweder aus dem Protein Tau, das fibriläre Strukturen innerhalb der Neuronen bildet („tau tangles“), oder aus extrazellulären Aggregaten von Amyloid β Peptiden (Aβ), den so genannten Amyloid Plaques. Aβ Peptide lösen nach heutigem Kenntnisstand eine Kaskade molekularer Ereignisse aus (Amyloid-Kaskade Hypothese), die letztlich zum Tod von Neuronen und den klinisch manifesten Symptomen der Alzheimer-Erkrankung führt. Diese Aβ Peptide entstehen durch eine schrittweise Prozessierung des Amyloid Precursor Protein (APP). In einem ersten geschwindigkeitsbestimmenden Schritt wird APP von dem Enzym β-Secretase (BACE1) geschnitten. Das entstandene Produkt wird daraufhin in einem zweiten Schritt von der γ-Secretase erneut geschnitten, was schließlich zur Freisetzung des Aβ Peptides in den extrazellulären Raum führt. Da BACE1 den geschwindigkeitsbestimmenden Schritt in der Generierung von Aβ katalysiert, ist dieses Enzym Gegenstand intensiver Forschung und gilt als viel versprechendes Ziel für die Entwicklung von Medikamenten gegen die Alzheimer Erkrankung. In Gehirnen von Alzheimer Patienten wurde eine erhöhte BACE1 Proteinexpression und Aktivität gefunden, welche für die vermehrte Entstehung von Aβ Peptiden verantwortlich gemacht wird. Zwar gibt es Hinweise darauf, dass BACE1 durch Aβ reguliert werden könnte und das BACE1 vor allem in der Nähe von Amyloid Plaques verstärkt vorhanden ist. Jedoch sind die Gründe und die tatsächliche Verteilung der erhöhten BACE1 Expression nach wie vor unbekannt.
Ziel meiner Arbeit ist es, die Regulation von BACE1 im Kontext der Alzheimer Erkrankung zu untersuchen. Dazu werde ich folgende drei Fragenkomplexe bearbeiten.
- Korreliert die Expression von BACE1 bzw. dessen Aktivität mit der Menge an Aβ Plaques und dem Fortschritt der Erkrankung? Ist die erhöhte Expression von BACE1 eine Konsequenz der vermehrten Aβ Produktion oder ist sie ein früheres Ereignis in der Alzheimer Pathologie, welche eine verstärkte Aβ Produktion erst ermöglicht?
- Wo im Gehirn und in welchem zellulären Kontext ist BACE1 verstärkt vorhanden?
- Angesichts der sehr hohen physiologischen BACE1 Expression während der Entwicklung und kurz nach der Geburt: Welche Konsequenzen ergeben sich im Hinblick auf die Generierung und Akkumulation von Aβ während dieser Phase? Wo befinden sich die Zellen mit hoher BACE1 Expression?
Die Untersuchung der BACE1 Regulation während der Entwicklung und im Verlauf der Alzheimer-Krankheit wird somit zu einem besseren Verständnis der frühen molekularen Ereignisse während der Entstehung von Alzheimer beitragen. Diese Erkenntnisse können bei der Entwicklung neuer Interventions- und Behandlungsstrategien von großem Vorteil sein.
Lebenslauf
| Name | Daniel Fleck |
| Geburtsort | Stuttgart |
| Geburtsdatum | 13. Juni 1981 |
| seit 2009 | Graduiertenprogramm „Neurodegenerative Disease Research“ im SFB 596, LMU München. |
| seit 2009 | Promotion bei Prof. Dr. Haass und Dr. Willem, Adolf-Butenandt Institut und DZNE, München. |
| 2008-2009 | Diplomarbeit bei Prof. Dr. Stevanovic, Institut für Zellbiologie und Immunologie, Tübingen und Prof. Dr. Haass, Adolf-Butenandt Institut, München. |
| 2007-2009 | Hauptstudium der Biochemie an der Eberhard Karls Universität Tübingen. Abschluss: Diplom Biochemiker. |
| 2006-2007 | Industriepraktikum bei F.Hoffmann-La Roche, Pharmaceuticals in Basel. |
| 2005-2006 | Praktikumsjahr an den Max Planck Instituten für Biochemie und Neurobiologie in Martinsried. |
| 2002-2004 | Grundstudium der Biochemie an der Eberhard Karls Universität Tübingen. |
Projektbeschreibung
Die Rolle des vaskulären, endothelialen Wachstumsfaktors (VEGF) während Prozessierung des ß- Amyloid- Vorläuferproteins
Die Hypothese, dass zwischen der Entstehung von sporadischen Formen der Alzheimerschen Erkrankung und vaskulären Krankheitsbildern ein kausaler Zusammenhang besteht, wurde schon vor mehr als 10 Jahren postuliert (de la Torre and Mussivand, 1993, de la Torre, 2008, Isingrini et al., 2009). So treten zerebrovaskuläre Veränderungen wie Verdickung der mikrovaskulären Basalmembran, Erweiterung der Gefäße (Vinters et al., 1996, Claudio, 1996; Ellis et al., 1996; Kalaria and Hedera, 1995; Kalaria and Pax, 1995; Mancardi et al., 1980), zerebrale Angiopathie und mikrovaskuläre, endotheliale Degeneration (de la Torre et al., 2002; Kalaria, 2000; Soffer, 2006; Thomas et al., 1996) häufig auch bei Alzheimerpatienten auf. Es gibt eine Reihe von Studien, die belegen, dass zerebrovaskuläre Degenerationen bei Morbus Alzheimer häufig im Zusammenhang mit den β- Amyloid- Ablagerungen zu sehen sind (Attems et al., 2004; Buee et al., 1994, 1997; Fischer et al., 1990; Kalaria, 1998, 2002; Mann et al., 1986; Suter et al., 2002). Aβ kann sowohl die Degeneration von großen Arterien, wie auch die von feinen zerebralen Kapillaren verursachen, was zu einer starken Beeinträchtigung der Hirndurchblutung und der Blut- Hirnschranke führen kann (Kalaria, 2002). Darüber hinaus wurden beschrieben, dass Aβ- Peptide die Angiogenese sowohl in vitro als auch in vivo hemmen (Paris et al., 2004a, b). Paris et al. konnte auch zeigen, dass APP sehr stark in Endothelzellen neuentstehender Gefäße exprimiert wird, und dass Blocker der α-and β- Sekretase zur Hemmung der Angiogenese und des Tumorwachstums führen (Paris et al., 2005). Dies führt zu der Annahme, dass der APP- Metabolismus auch eine Rolle während der Angiogenese spielt. In dem Artikel von Ruiz de Almodovar et al. (2009) wird beschrieben, dass eine Veränderung und Fehlregulation der angiogenen Faktoren zu verschiedenen neurologischen Erkrankungen, wie auch der Neurodegeneration führen kann.
Eines der wichtigsten angiogenen Faktoren ist der vaskuläre, endotheliale Wachstumsfaktor (VEGF). Er ist ein hochkonserviertes Heparin- bindendes Protein (Sun and Guo, 2005), der ursprünglich in vaskulären Endothelzellen entdeckt wurde. VEGF induziert die Proliferation und Migration von Endothelzellen, beeinflusst aber auch die Gefäßpermeabilität in vielen Gewebetypen (Ferrara et al., 2003).
Im Vergleich mit gleichaltrigen gesunden Probanden konnte im Gehirn von Alzheimer Patienten intrathekal erhöhte VEGF- Konzentrationen gemessen werden (Kalaria et al., 1998; Tarkowski et al., 2002; Yang et al., 2004). Dabei korrelierte der VEGF- Anstieg mit dem Schweregrad der Erkrankung (Ryu et al., 2009). Die funktionelle und physiologische Bedeutung der VEGF- Erhöhung während der Entstehung und Entwicklung von Morbus Alzheimer bleibt jedoch noch umstritten. Während einige Autoren eine Verbesserung von Morbus Alzheimer durch VEGF und andere angiogene Faktoren zeigen konnten (Vagnucci and Li, 2003, Pogue and Lukiw, 2004; Thirumangalakudi et al., 2006, Desai et al., 2009), gibt es kaum Hinweise auf ein Neovaskularisierung, dafür aber erhebliche zerebrovaskuläre Anomalien und Degenerationen im Gehirn von Alzheimer Erkrankten (Zipser et al., 2007). Im Vergleich mit gesunden Kontrollgruppen konnte bei AD- Patienten nur im Hippokampus eine erhöhte Gefäßdichte durch eine stattfindende Angiogenese entdeckt werden (Desai et al., 2009). Es wird davon ausgegangen, dass die mikrovaskulären Degenerationen bei AD die Folge von Aβ- Ablagerungen in den Gefäßen ist (Schultheiss et al., 2006; Cole and Vassar, 2008). Auf der anderen Seite kann Ischämie und eine Hypofusion die Akkumulation und Spaltung von APP auslösen und somit die β- Amyloid- Ablagerung begünstigen (Bennett et al., 2000; Jendroska et al., 1995). Allerdings sind die Mechanismen, wie diese Erkrankungen die β-Amyloid- Bildung beeinflussen, unbekannt. An einer veränderten Prozessierung von APP ist vermutlich die erhöhte Expression von VEGF, die durch Hypoxie, ischämischen oder hypoglykämischen Stress ausgelöst werden kann, beteiligt (Marti et al., 1998, 2000; Stein et al., 1995; Yancopoulos et al. 2000). Aktuelle Studien zeigen einen Einfluss von VEGF bei der Mikroglia- vermittelten Entzündungsreaktion auf Aβ- Peptide (Ryu et al., 2009). Es wird eine erhöhte Expression des VEGF- Rezeptors Flt-1 im Gehirn von Alzheimer Patienten nachgewiesen. Flt-1 hat chemtotaktische Eigenschaften, wird von Mikrogliazellen exprimiert und kann weitere Mikrogliazellen anlocken. Blocker von Flt-1 führen zu einer eingeschränkten Mobilität der Mikrogliazellen (Ryu et al., 2009). Da vaskuläre Endothelzellen in der Lage sind, APP zu exprimieren und zu sekretieren (Ciallella et al., 1999), kann auch VEGF Einfluss auf die Entstehung und Ablagerung von Aβ haben. Zusammengefasst gibt es zahlreiche Hinweise, die die Hypothese bestärken, dass VEGF zusätzlich zu seinen angiogenen, neuroprotektiven und neurogenen Eigenschaften auch Einfluss auf die APP- Prozessierung und somit auf die Entstehung und das Voranschreiten der Alzheimerschen Erkrankung ausüben kann.
Ziele
Im Rahmen des Projektes soll untersucht und bewiesen werden, ob die erhöhte VEGFKonzentration bei der Alzheimerschen Erkrankung eine wichtige Rolle bei Prozessierung von dem Amyloid- Vorläuferprotein spielt und somit den Verlauf der Erkrankung beeinflussen kann.
Zur Prüfung dieser Hypothese müssen die folgenden Zielfragen beantwortet werden.
1. Ziel: Gibt es einen Einfluss von VEGF auf den APP- Metabolismus in- vitro?
2. Ziel: Ist dieser Effekt auf die APP- Prozessierung zelltyp-spezifisch?
3. Ziel: Wird der neuronale APP- Metabolismus durch endogen produzierten VEGF
von Hypoxie- gestressten Endothelzellen beeinflusst?
4. Ziel: Kann VEGF die Aggregation und die Fibrillenbildung von β- Amyloid- Peptiden auslösen?
Am Ende des Projektes besteht die Möglichkeit sich ein umfangreiches Bild über die Zusammenhänge der VEGF- Erhöhung und der β- Amyloidgenese im Verlauf der Alzheimerschen Erkrankung zu machen. Diese neuen Erkenntnisse könnten einen Ansatzpunkt darstellen, neue Strategien zu entwickeln, um Morbus Alzheimer durch eine Beeinflussung von VEGF- vermittelten Mechanismen zu behandeln.
Lebenslauf
| Name | Susanne Bürger |
| Geburtsort | Halle/Saale, Deutschland |
| Geburtsdatum | 18. Juli 1981 |
| 2008-2009 | wissenschaftlicher Mitarbeiter (Doktorand) am Paul- Flechsig Institut für Hirnforschung der Universität Leipzig Promotionsthema: Vascular Endothelial Growth Factor (VEGF) in ßamyloidogenesis, finanziert durch die Alzheimer Forschung Initiative (AFI) |
| 2007 | Abschluss als Diplombiologin (Note: 1,6), Friedrich- Schiller Universität, Jena , Thema der Diplomarbeit: „Analyse der Expression der Verdrahtungsmoleküle der Semaphorin-, Neuropilin-, Plexin- Familie während der thalamokortikalen Entwicklung der Maus“ Nachwuchsgruppe Neurogenetik |
| 2002-2006 | Studium der Biologie, Friedrich-Schiller-Universität, Jena, Schwerpunkte: Neurowissenschaften, Zoologie, Zellbiologie und Immunbiologie |
| 2000-2002 | Magisterstudium (Biologie, Erziehungswissenschaften, Mathematik), Friedrich-Schiller-Universität; Jena |
Publikationen
WISSENSCHAFTLICHE VERÖFFENTLICHUNGEN
1. Bürger S, Noack M, Kirazov LP, Kirazov EP, Naydenov CL, Kouznetsova E, Yafai Y, Schliebs R. (2009)
Vascular endothelial growth factor (VEGF) affects processing of amyloid precursor protein and ß-amyloidogenesis in brain slice cultures derived from transgenic Tg2576 mouse brain. Int J Dev Neurosci, 27 (6):517-23
WISSENSCHAFTLICHE ABSTRACTS/ TAGUNGSBEITRÄGE
1. S. Bürger, M. Noack, E. Kouznetsova, Y. Yafai, L. Kirazov, E. Kirazov, R. Schliebs
Vascular Endothelial Growth Factor (VEGF) affects processing of amyloid precursor protein and β-amyloidogenesis in brain slice cultures derived from transgenic Tg2576 mouse brain. 18th European Society for Neurochemistry (ESN), 4th Conference on Advances in Molecular Mechanisms of Neurological Disorders, Leipzig, July 11-14, 2009. Abstract in: J. Neurochem. 110, Suppl. 1, 2009, pp. 40-41
2. S. Bürger, M. Noack, E. Kouznetsova, Y. Yafai, L. Kirazov, E. Kirazov, R. Schliebs (2009)
Vascular Endothelial Growth Factor (VEGF) affects processing of amyloid precursor protein and beta-amyloidogenesis in brain slice cultures derived from transgenic Tg2576 mouse brain. Saxon Biotechnology Symposium, May 26, 2009, in Leipzig. Abstract in: Saxon Biotechnology Symposium 2009, Abstracts book (Eds. A.A. Robitzki, M. Blessing, T. Züchner, M. Brand, F. Stewart, A. Beyer, E. Schäffer), Leipzig 2009 (ISBN-Nr. 978-3-00-027884-6), p. 201.
3. S. Bürger, M. Noack, L. Kirazov, E. Kirazov, E. Kouznetsova, R. Schliebs (2008)
Effect of Vascular Endothelial Growth Factor (VEGF) on processing of amyloid precursor protein in brain slices and primary cultures derived from transgenic Tg2576 mice. 7th Leipzig Research Festival for Life Sciences, 12. Dezember 2008. Abstract in: 7th Leipzig Research Festival for Life Sciences Abstract Book (J. Thiery, A. Beck-Sickinger, T. Arendt, Hrsg.), Leipzig (ISBN-Nr. 3-9810760-4-4), S. 11.
Projektbeschreibung
Zusammenfassung der Promotion “Entstehung von Aβ-Peptiden und deren molekulare Wechselwirkungen bei der Bildung toxischer Oligomere“
Für die Pathogenese der Alzheimer Krankheit sind besonders die hydrophben Amyloid-β (Aβ)-Peptide mit einer Länge von 42 Aminosäuren verantwortlich. Diese neurotoxischen Peptide werden nach der proteolytischen Spaltung des membranständigen Amyloid Vorläuferproteins (APP) durch die β-Sekretase und folgender sequenzieller Schnitte der γ-Sekretase in den Extrazellulärraum freigesetzt. In den letzten Jahren konnte überzeugend gezeigt werden, dass lösliche, niedere Aβ-Oligomere die Integrität der Synapsen schädigen und für neuronalen Zelltod verantwortlich sind. Aggregate dieser Peptide, sogenannte Plaques, korrelieren hingegen nicht mit den Symptomen der Krankheit.In diesem Promotionsvorhaben sollen zwei Teilprojekte verfolgt werden. Im ersten Teil soll der sequenzielle Schnittmechanismus der γ-Sekretase und die Entstehung von Aβ42-Peptiden als Vorläufer von weiteren verkürzten Formen aufgeklärt werden. Die Untersuchung der Wirkungsweise der γ-Sekretase soll ein besseres Verständnis darüber geben, ob und wie toxische Aβ-Oligomere während und/oder nach der Prozessierung von APP durch die γ-Sekretase entstehen und wie die Freisetzung unterschiedlich langer Peptide aus dem γ-Sekretase-Komplex erfolgt. Im zweiten Teilprojekt sollen die hydrophoben Wechselwirkungen der entstehenden Aβ-Peptide analysiert werden, da deren neurotoxische Wirkung vermutlich durch Interaktionen mit sich selbst, Lipiden und/oder membrangebundenen Rezeptoren vermittelt werden. Die biochemische Untersuchung von Aβ-Aβ bzw. Aβ-Lipid Interaktionen, soll schließlich einen neuen Einblick gewähren, wie diese Peptide die Toxizität gegenüber neuronalen Zellen auf molekularer Ebene vermitteln. Aus den Ergebnissen des Promotionsprojektes sollen letztlich gezielte Ansätze abgeleitet werden, die geeignet sind, die Toxizität von bestimmten Aβ Formen als Ursache der Alzheimerkrankheit zu bekämpfen.
Lebenslauf
| Name | Veit Samuel Althoff |
| Geburtsort | Berlin, Deutschland |
| Geburtsdatum | 22. August 1979 |
| seit 08/2008 | Beschäftigung als wissenschaftlicher Mitarbeiter am Institut für Chemie und Biochemie der FU-Berlin in der Arbeitsgruppe von Herrn Prof. Dr. G. Multhaup im Bereich der SPR/MALDI-MS Core Facility |
| 2006 – 2008 | Studium der Biomedizin an der Universität Würzburg, Abschluss: Master of Science in Biomedizin (Gesamtnote 1,4). Masterarbeit: „Untersuchungen zur Prozessierung des Signalpeptids der Dihydrolipoamid Dehydrogenase“ (Note 1,0) |
| 2002 – 2005 | Studium der Biomedizin an der Universität Würzburg, Abschluss: Bachelor of Science in Biomedizin (Gesamtnote 2,6). Bachelorarbeit: „Genotypisierung von SNPs im humanen FZD3-Gen in einem Kollektiv von Schizophrenie-Patienten“ (Note 1,0) |
Projektbeschreibung
Analysierung der molekularen und zellulären Mechanismen, wodurch HDACS die neuronale Funktion während kognitiver Prozesse und in der Alzheimer Erkrankung beeinflussen
Der Begriff Epigenetik beschreibt vererbare Änderungen in der Genexpression, die nicht durch Modifizierungen der DNA-Sequenz verursacht werden. Die zwei am besten erforschten epigenetischen Phänomene sind die DNA-Methylierung und die Modifizierungen an den endständigen Histonarmen. Die DNA ist in ihrer grundlegensten strukturellen Einheit um acht Histone gewickelt (Dimere aus H2A, H2B, H3 und H4). Die basischen aminoterminalen endständgigen Histonarme können auf verschiedene Weise post-translational modifiziert werden, zum Beispiel acetyliert, methyliert und ubiquitiniert. Dies stellt ein konkretes chemisches Erkennungsmuster dar, welches von Proteinen erkannt wird und an welche sie binden können. Diese Muster bezeichnet man häufig als „Histon-Code“. Acetylierungen an spezifischen Lysinstellen an H3 und H4 führen zu Lockerung der Chromatinstruktur, wodurch die Bindung an DNA-bindende Proteine, zum Beispiel Transkriptionsfaktoren, erleichtert wird. Generell wird Histonacetylierung als die Genexpression verstärkend angesehen. Die Acetylierung von Histonen erfolgt durch Histon-Acetyl-Transferasen (HAT) und Histon-Deacetylasen (HDAC), die Acetylgruppen an die Histonarme anhängen bzw. entfernen. Vor kurzem veröffentliche Ergebnisse unserer Arbeitsgruppe und von anderen Gruppen zeigen, dass Lernverhalten durch einen epigenetischen Mechanismus gefördert wird und Tieren mit Neurodegeneration den Zugriff auf verloren gegangene Erinnerungen aus dem Langzeitgedächtnis ermöglicht (Fischer, 2007; Alacorn, 2004; Beglopoulos, 2006). Ebenfalls führt eine Inhibierung der HDAC-Aktivität zur Verbesserung der kognitven Fähigkeiten bei Wildtyp-Mäusen (Levenson, 2004). Bis heute ist jedoch nur wenig über die Rolle der HDACs in Neuronen, beim Lernen und der Gedächtnisbildung bekannt. Mit meinem Projekt möchte ich den grundlegenden Mechanismus erforschen, wie epigenetische Prozesse, im besonderen die HDAC-Aktivität, die synaptische Plastizität, Lernen und das Langzeitgedächtnis beeinflussen. Ich bin sehr daran interessiert, herauszufinden, welche der 11 Zink-abhängigen humanen HDACs einen positiven Effekt auf die neuronale Plastizität haben. Ich hoffe, dass mein Projekt weiter zum Verständnis des molekularen Mechanismus, dem die Gedächtnisbildung unterliegt, beiträgt. Dies ist auch bei der Entwicklung neuer Strategien für die Behandlung der Alzheimer Erkrankung von Nutzen.
Lebenslauf
| Name | Nambirajan Govindarajan |
| Geburtsdatum | 24.05.1982 |
| Geburtsort | Kolkata (Indien) |
| seit 2007 | Promotion im Labor für Altersforschung und kognitive Erkrankungenm European Neuroscience Institute, Göttingen, Arbeitsgruppe von Dr. Amdre Fischer |
| 2003-2005 | Masterstudium „Molecular Biology“, International Max Planck Research School, Göttingen |
| 2000-2003 | Bachelorstudium Humanbiologie, All India Institute of Medical Sciences, Neu Delhi, Indien |
Referenzen
- Alarcon, J. M., Malleret, G., Touzani, K., Vronskaya, S., Ishii, S., Kandel, E. R., and Barco, A. (2004). Chromatin acetylation, memory, and LTP are impaired in CBP+/- mice: a model for the cognitive deficit in Rubinstein-Taybi syndrome and its amelioration. Neuron 42, 947-959.
- Beglopoulos, V., and Shen, J. (2006). Regulation of CRE-dependent transcription by presenilins: prospects for therapy of Alzheimer’s disease. Trends in Pharmacological Sciences 27, 33-41.
- Fischer, A., Sananbenesi, F., Pang, P. T., Lu, B., and Tsai, L. H. (2005). Opposing roles of transient and prolonged expression of p25 in synaptic plasticity and hippocampus-dependent memory. Neuron 48, 825-838.
- Levenson, J. M., O’Riordan, K. J., Brown, K. D., Trinh, M. A., Molfese, D. L., and Sweatt, J. D. (2004). Regulation of histone acetylation during memory formation in the hippocampus. J Biol Chem 279, 40545-40559.
Zusammenfassung der Arbeit
Die Alzheimer Erkrankung ist die häufigste Form von Demenz bei älteren Menschen. Die Hauptkomponente der amyloiden Plaques im Gehirn von Alzheimer Patienten sind die Aβ Peptide, welche durch die Aktivität der g-Sekretase in den extrazellulären Raum gelangen. Die g-Sekretase ist ein multimerer Komplex von hohem Molekulargewicht und besteht aus den Untereinheiten Präsenilin (PS), Nicastrin, anterior pharynx-defective phenotype 1 (Aph1) und PS enhancer 2 (Pen2). In einer vorausgehenden Arbeit wurde ein Qualitätskontrollmechanismus für den Zusammenbau der g-Sekretase vorgeschlagen. Dieser Mechanismus basiert auf Retentionssignalen, welche die isolierten Untereinheiten und Zwischenformen des Zusammenbaus im endoplasmatischen Retikulum (ER) halten. Diese Signale werden im korrekt assemblierten Komplex inaktiviert und die g-Sekretase wird an die Plasmamembran und in die Endosomen transportiert, wo sie aktiv ist. Das Ziel der vorliegenden Arbeit war es, Belege für die vorgeschlagene Qualitätskontrolle beim Zusammenbau der g-Sekretase zu finden. Der erste Schritt dieser Arbeit war die Identifizierung von ER Retentionssignalen in den verschiedenen Untereinheiten der g-Sekretase. Durch die Anwendung von Reporterproteinen konnten zwei neuartige ER Retentionssignale identifiziert werden, welche in der Transmembrandomäne (TMD) 4 von PS1 und der TMD1 von Pen2 liegen. Beide Signale basieren auf polaren Aminosäuren im hydrophoben Umfeld einer TMD. Das Signal in der Pen2-TMD1 trägt außerdem zur Stabilität von Pen2 bei. Die Mutagenese der zwei bekannten Retentionssignale in PS1 (TMD4 und TMD9) führte nicht zum Export von PS1 aus dem ER. Daher ist zu vermuten, dass es weitere Signale in PS1 gibt, entweder in den verbleibenden 7 TMD oder in den zytoplasmatischen Bereichen von PS1.
Der zweite Teil der vorliegenden Arbeit zielte auf die Identifizierung von Komponenten, welche die TMD-basierte ER Retention vermitteln. Retention in the ER 1 (Rer1) wurde als ein Protein identifiziert, das zur ER Retention von Pen2, jedoch nicht von PS1, beiträgt. Pen2 ist das erste bekannte Substrat von Rer1 in Säugetierzellen wobei Rer1 mit Pen2 durch die Bindung an die Pen2-TMD1 interagiert. Die Unabhängigkeit des Signals in der PS1-TMD4 von Rer1 impliziert, dass es weitere bisher unbekannte Mechanismen gibt, welche zur TMD-basierten ER Retention beitragen. Als Drittes wurde ein Mechanismus aufgeklärt, durch welchen ER Retentionssignale in der assemblierten g-Sekretase inaktiviert werden. Ergebnisse von uns und anderen zeigten bereits, dass die Pen2-TMD1 und die PS1-TMD4 notwendig für die Interaktion von PS1 und Pen2 sind. Dementsprechend sind beide TMD bifunktional, da sie sowohl zu einer Protein-Protein Interaktion als auch zur ER Retention beitragen. In der vorliegenden Arbeit konnte gezeigt werden, dass diese Protein-Protein Interaktion zu einer Maskierung und somit zur Inaktivierung der Retentionssignale in beiden TMD führt. Auf diese Art und Weise sind beide Funktionen der TMD aneinander gekoppelt. Diese Kopplung kann von der ER Qualitätskontrolle genutzt werden, um den Prozess des Zusammenbaus der g-Sekretase zu überwachen. Höchstwahrscheinlich kann dieser Mechanismus für andere multimere Proteine wie Ionenkanäle und Rezeptoren an der Plasmamembran verallgemeinert werden.
Darüber hinaus wurde hier gezeigt, dass die stabile überexpression der PS1-TMD4 den beschriebenen Qualitätskontrollmechanismus stört und somit den Zusammenbau der g-Sekretase verhindert. Diese Beobachtung hebt die Rolle der TMD der g-Sekretase nochmals hervor. Zudem eröffnet sie eine Möglichkeit zur pharmakologischen Beeinflussung der g-Sekretase über ihre TMD, welche genutzt werden könnte, um dieses wichtige Enzym bei pathologischen Zuständen zu inhibieren.
Projektbeschreibung
Zusammenfassung der Promotion “Zum Verständnis der Rolle von Rer1 beim Zusammenbau der g-Sekretase“
Die g-Sekretase ist ein Proteinkomplex mit großem Molekulargewicht bestehend aus den 4 Untereinheiten Presenilin (PS), Nicastrin, Aph1 und Pen2. Der fertige g-Sekretasekomplex zeigt die Aktivität einer Protease und spaltet verschiedene Substrate wie das Amyloid-Vorläuferprotein (APP) innerhalb ihrer Transmembrandomänen. Dadurch vermittelt die g-Sekretase den letzten Schritt in der Produktion des Amyloid-b-Peptides (Ab). Ab ist die Hauptkomponente der Amyloidplaques in den Gehirnen von Alzheimer Patienten.
Der g-Sekretasekomplex assembliert sich im endoplasmatischen Retikulum (ER) und wird anschließend zu den Orten der g-Sekretaseaktivität transportiert. Eine Qualitätskontrolle stellt sicher, dass nur vollständig und korrekt assemblierte g-Sekretase das ER verlässt. Nach unserer Hypothese liegen diesem Mechanismus ER-Retentionssignale zu Grunde, welche die nicht-assemblierten Untereinheiten im ER zurückhalten. Durch den Zusammenbau des Komplexes werden diese Signale maskiert und der Komplex interagiert nicht länger mit Proteinen, welche die ER-Retention vermitteln. Wir haben bereits in den Untereinheiten PS1 und Pen2 ER-Retentionssignale identifiziert, welche innerhalb der Transmembranbereiche der Proteine liegen. Des Weiteren haben wir das Protein Rer1 identifiziert, dass die ER-Retention der Untereinheit Pen2 über eine Transmembrandomäneninteraktion vermittelt. Deshalb vermuten wir, dass Rer1 durch seine Interaktion mit Pen2 einen Einfluss auf den Zusammenbau der g-Sekretase hat. Im vorgeschlagenen Projekt wollen wir den molekularen Mechanismus des Zusammenbaus des g-Sekretase näher untersuchen. Insbesondere wollen wir die Rolle von Rer1 bei diesem Prozess aufklären. Es wird ein siRNA Screen durchgeführt, um Interaktionspartner der transmembranbasierten Retention zu identifizieren. Zu diesem Zweck werden wir Reporterproteine verwenden, welche Rer1-abhängig im ER zurückgehalten werden. Die Lokalisation dieser Reporterproteine dient als Sensor für die Integrität der Rer1-basierten Qualitätskontrolle. Zellen, die diese Reporterproteine stabil exprimieren, werden mit einer siRNA-Bank transfiziert. Anschließend wird die Lokalisation der Reporterproteine über High Content Mikroskopie analysiert. Zusätzlich werden wir nach direkten Interaktionspartnern von Rer1 suchen. Dazu werden wir einen auf einer humanen Gehirn-cDNA-Bank basierenden Hefe-Zwei-Hybrid-Screen durchführen. Es ist wahrscheinlich, dass wir in den beschriebenen Screens Proteine identifizieren, welche den Qualitätskontrollmechanismus für die g-Sekretase beeinflussen. Diese Proteine werden dann näher untersucht, um ihre exakte Funktion beim Zusammenbau der g-Sekretase aufzuklären.
Lebenslauf
| Name | Matthias Faßler |
| Geburtsort | Jena |
| Geburtsdatum | 28.10.1980 |
| seit 2005 | Doktorand bei Dr. Christoph Kaether, AG Membrantransport, Fritz-Lipmann-Institut Jena |
| 2002-2003 | Tutor, FSU Jena |
| 2002-2005 | Studium der Biochemie und Molekularbiologie an der Friedrich-Schiller-Universität Jena, Wahlpflichtfach molekulare Medizin, Abschluss als Diplom-Biochemiker/ Molekularbiologe, Note 1,3 |
Publikationen
Kaether, C., Scheuermann, J., Fassler, M., Zilow, S., Shirotani, K., Valkova, C., Novak, B., Kacmar, S., Steiner, H. and Haass, C. (2007) Endoplasmic reticulum retention of the gamma-secretase complex component Pen2 by Rer1. EMBO Rep, 8, 743-748.
Lebenslauf
| Name | Martin Siepmann |
| Geburtsort | Münster |
| Geburtsdatum | 08.05.1977 |
| seit 2005 | Doktorand, Molekulare Zellbiologie AG Prof. Dr. Jochen Walter, Universität Bonn |
| 2003/2004 | Diplomarbeit “Funktionale Analyse der mittleren Domäne von Hsp90 mit molekularbiologischen und biochemischen Methoden”, Protein Folding Group AG Dr. Wolfgang Obermann, Genetisches Institut, Universität Bonn |
| 1998-2004 | Studium der Diplombiologie an den Universitäten Darmstadt und Bonn |
Projektbeschreibung
Molekulare Mechanismen der Neprilysin Regulation
Die Akkumulation des Amyloid ß-Peptides (Aß) ist eines der beiden typischen neuropathologischen Merkmale der Alzheimer´schen Erkrankung. Aß entsteht bei der proteolytischen Prozessierung des Amyloid Vorläuferproteins (ßAPP) durch zwei spezifische membrangebundene Proteasen. Allerdings wird die Aß Menge im Gehirn nicht nur durch die Aktivität der Proteasen festgelegt, die an der Produktion von Aß beteiligt sind, sondern auch durch Enzyme, die Aß abbauen können. Unter ihnen spielen vor allem Zink-Metalloproteasen eine große Rolle, wie zum Beispiel das Insulin abbauende Enzym IDE, die Endothelin-konvertierenden Enzyme ECE-1 und -2 und das Typ II Membran Protein Neprilysin (NEP). So konnte gezeigt werden, dass eine Erhöhung der NEP Expression bzw. der NEP Aktivität einen verstärkten Abbau von Aß und eine Verringerung der Aß Ablagerungen zur Folge hat. Im Rahmen dieser Doktorarbeit sollen die molekularen Mechanismen identifiziert werden, die den subzellulären Transport und die Aktivität von NEP regulieren. Mit Hilfe von biochemischen und zellbiologischen Methoden soll vor allem die Rolle der NEP Phosphorylierung untersucht werden. In ersten Untersuchungen, konnte gezeigt werden, dass NEP sowohl in vitro, als auch in vivo phosphoryliert wird. In den folgenden Untersuchungen werde ich mich vor allem auf die Charakterisierung des zugrunde liegenden Signalweges, der darin mitwirkenden Proteinkinasen und der Bestimmung der NEP Phosphorylierungsstelle konzentrieren. Frühere Untersuchungen haben gezeigt, dass der Somatostatinsignalweg die NEP Aktivität und Lokalisation beeinflussen kann. Hier wird zu untersuchen sein, ob die NEP Phosphorylierung an diesem Prozess beteiligt ist. Die Ergebnisse dieses Promotionsprojektes sollten neue Einblicke in die molekulare Regulation und den Aß Abbau durch NEP geben, so dass eventuell neue therapeutische Ansätze gefunden werden können, die zu einer Reduzierung der Aß Menge und somit auch der Aß Ablagerungen im Gehirn führen würden.
Publikationen
1. Hawle P, Siepmann M, Harst A, Siderius M, Reusch HP, Obermann WM. The middle domain of Hsp90 acts as a discriminator between different types of client proteins. Mol Cell Biol. 2006 Nov;26(22):8385-95
2. Siepmann M, Kumar S, Mayer G, Walter J. Phosphorylation of Neprilysin by Casein Kinase 2 inhibits interaction with PTEN and increases insulin-dependent signaling via Akt. J Biol Chem. (in revision)
Kongressbeiträge:
1. Siepmann M., Kumar S., Walter J.: “Analysis of Neprilysin Phosphorylation” 8th International Conference on Alzheimer’s and Parkinson’s Disease (AD/PD) Salzburg (15.03.2007)
2. Siepmann M., Kumar S., Walter J.: “Analysis of Neprilysin Phosphorylation” 8th Gathering of German-International Alzheimer’s Researchers, Eibsee Meeting (30.10.2009)
Projektbeschreibung
Rolle von Parkin in Stress-Signalwegen
Die Parkinson-Erkrankung ist die zweithäufigste neurodegenerative Krankheit nach der Alzheimer-Erkrankung. Sie ist gekennzeichnet durch einen weit gehend selektiven und progressiven Verlust von dopa- minergen Neuronen in der Substantia nigra pars compacta. In den letzten Jahren konnten mehrere monogen erbliche Formen der Parkinson-Erkrankung identifiziert werden. Über die Ursachen der sporadischen Parkinson-Erkrankung ist noch wenig bekannt; die Aufklärung der Funktion Parkinson-assoziierter Gene lässt auf Einblicke in die Pathomechanismen der Parkinson-Erkrankung hoffen. Parkin nimmt unter den Parkinson-assoziierten Genen eine besondere Stellung ein, da Mutationen im Parkin-Gen für die Mehrzahl der autosomal rezessiven Fälle verantwortlich gemacht werden. Das Parkin-Gen codiert ein 465 Aminosäure langes Protein mit einer Ubiquitin-ähnlichen Domäne (UBL) am N-Terminus und einer RBR- Domäne mit zwei RING-Finger-Motiven nahe des C-Terminus. Das Vorhandensein der RBR-Domäne deutet darauf hin, dass Parkin eine E3-Ubiquitin-Ligase-Aktivität besitzt. Es wurden bisher mehrere mögliche Substrate von Parkin beschrieben, allerdings konnten diese bislang nicht zum Verständnis der physiologischen Funktion von Parkin beitragen. In verschiedenen Modellsystemen konnte eine neuroprotektive Wirkung von Parkin gegenüber verschiedenen Stressoren beobachtet werden, darunter oxidativer Stress, mitochondrialer Stress und ER (Endoplasma- tisches Retikulum) -Stress. In meinem PhD-Projekt möchte ich mich mit dem Mechanismus der zytoprotektiven Aktivität von Parkin beschäftigen. Das Ziel meiner Arbeit ist es, die Regulation der Aktivität von Parkin zu verstehen und Signalwege zu identifizieren, welche die zytoprotektiven Eigenschaften von Parkin vermitteln. Interessanterweise kann Parkin Neuronen sowohl vor mitochondrialem als auch vor ER-Stress schützen. Beide Organellen spielen eine wichtige Rolle bei der Regulierung von pro- und anti-apoptotischen Signalwegen nach zellulärem Stress. Daher stellt sich die Frage, ob Parkin eine Rolle im interorganellen Crosstalk zwischen Mitochondrium und ER spielt. Einblicke in die physiologische Funktion von Parkin und die Identifizierung von Signalwegen, die von Parkin beeinflusst werden, können als Basis für die Entwicklung von neuen therapeutischen Strategien dienen, die das Voranschreiten der Parkinson-Erkrankung aufhalten oder verlangsamen können.
Lebenslauf
| Name | Lena Bouman |
| Geburtsort | Heidelberg |
| Geburtsdatum | 18.01.1979 |
| seit 2005 | Promotion in der Arbeitsgruppe von PD Dr. K.F. Winkelhofer am Adolf-Butenandt-Insitut, Ludwig-Maximilians-Universität, München |
| 2003-2004 | Diplomarbeit in der Arbeitsgruppe von Prof. J. Darnell an der Rockefeller University, New York, USA (Betreuer: M. Henrikson, PhD) |
| 2001-2004 | Hauptstudium der Biologie an der Eberhard-Kalrs-Universität Tübingen |
| 2000-2001 | Erasmusaufenthalt an der Université XI, Frankreich |
| 1998-2001 | Grundstudium der Biologie an der Phillips-Universität Marburg |

Projektbeschreibung
Mechanismen des Proteinabbaus bei Demenzen
In Deutschland leben derzeit über eine Million Menschen, die an einer Demenz erkrankt sind. Nach Schätzungen der World Health Organisation sind Demenzen wie z. B. die Alzheimer´sche Erkrankung die vierthäufigste Todesursache bei Personen über dem 60. Lebensjahr. Es ist bisher unklar, welche die genauen Ursachen für die Entstehung einer Demenz sind. Es wird jedoch angenommen, dass alle Demenzen einen gemeinsamen Entstehungsmechanismus aufweisen. Eine Schlüsselrolle bei einer Vielzahl neurodegenerativer Erkrankungen spielt dabei die Akkumulation von fehlgefaltetem Protein. Die Akkumulation von fehlgefaltetem Protein ist ein dynamischer Prozess, der in einer Störung des Gleichgewichts zwischen Proteinsynthese und -abbau resultiert. Das Ergebnis ist eine Proteinaggregation in den Zellen, die als Ursache für eine darauf folgende Demenz angesehen wird. Die familiäre Enzephalopathie mit Neuroserpineinschlüssen (FENIB) ist eine erbliche Erkrankung des Gehirns, die schon in frühen Stadien des Lebens zu Demenz führt. Ein Protein, das dem Neuroserpin sehr ähnlich ist, findet sich im Fadenwurm Caenorhabditis elegans (C. elegans). Durch Veränderung des natürlicherweise vorkommenden Proteins, ist es möglich die Erkrankung im Wurm nachzustellen und mit bestimmten Methoden zu untersuchen. Im lebenden Wurm können gezielt einzelne Proteine abgeschaltet werden und somit bestimmte Signalwege, die mit dem Protein interagieren, aufgeklärt werden. Ebenso ist es möglich, im lebenden Organismus Substanzen zu testen, die den Beginn der Erkrankung verhindern oder verzögern sollen. Das Ziel meiner Doktorarbeit ist es Signalwege zu finden, die im Abbau von aggregiertem Protein eine Rolle spielen. Hierfür haben wir ein C. elegans basiertes Modell generiert, in dem aggregationsanfällige Mutanten mit einem Fluoreszenzprotein gekoppelt sind. Dies erlaubt uns im lebenden Organismus Gene zu analysieren und Substanzen in einem hohen Durchsatz zu testen. Die erzielten Ergebnisse können dann auf ein Zellkultursystem und auf ein bereits etabliertes Mausmodell übertragen werden. Daten aus diesen Studien werden dazu beitragen neue Mechanismen des Proteinabbaus bei Demenzen aufzuklären.
Lebenslauf
| Name | Sascha Norbert Lange |
| Geburtsort | Hamburg |
| Geburtsdatum | 20.11.1976 |
| seit 07.2018 | Siemens Healthcare Diagnostics Inc. Tarrytown, New York, USA Senior Manager Clinical Affairs |
| 08.2014 – 06.2018 | Siemens Healthcare Diagnostics Products GmbH, Marburg Head of Clinical Affairs HE2 T1 (Hemostasis Evaluation 2 Team 1) |
| 03.2013 – 12.2013 | Euroimmun Medizinische Labordiagnostika AG, Lübeck Scientific Editor/Medical Writer im Produktmanagement/Marketing |
| 10.2011 – 02.2013 | Universitätsklinikum Hamburg-Eppendorf, III. Medizinische Klilnik und Poliklinik, Hamburg PostDoc |
| 06.2011 | Promotion, Dr. rer. nat. (magna cum laude) Institut für Neuropathologie, Universitätsklinikum Hamburg-Eppendorf |
| 07.2006 – 09.2011 | Universität Köln, Institut für Genetik, Köln Universitätsklinikum Hamburg-Eppendorf, Institut für Neuropathologie, Leitung: Prof. Dr. med. Markus Glatzel Promotionsstudent und PostDoc |
| 11.2005 – 06.2006 | Interdisziplinäre Klinik und Poliklinik für Stammzelltransplantation, Universitätsklinikum Hamburg-Eppendorf, Leitung: Prof. Dr. med. Dr. h.c. Axel R. Zander Wissenschaftlicher Mitarbeiter |
| 2004 – 2005 | Diplomarbeit am Zentrum für Molekulare Neurobiologie Hamburg, Institut für Molekulare Neuropathobiologie Leitung: Prof. Dr. med. Dr. rer.nat. Thomas J. Jentsch Thema: „Analyse von (konditionalen) Kalium-Chlorid- Kotransporter (KCC) Knockout-Mäusen“ |
| 2004 | Diplomprüfungen Biochemie Abschluss: Diplom-Biochemiker (Note: 1,6) |
| 10.2000 – 08.2005 | Studium Biochemie/Molekularbiologie, Universität Hamburg |
Zur Publikation von Sascha Lange (PDF-Dokument, 5.2 MB)
Projektbeschreibung
Molekulare Mechanismen der spinozerebellären Ataxie Typ 3 (SCA3)
Die spinozerebelläre Ataxie Typ 3 (SCA3) ist eine der häufigsten Ataxien und wird autosomal dominant vererbt. Sie gehört zu einer Gruppe von mindestens neun Polyglutamin-erkrankungen. Diese werden durch die pathogene Anhäufung der Aminosäure Glutamin in dem jeweiligen Protein hervorgerufen, welches Missfaltung und die anschließende Akkumulation des unlöslichen Proteins verursacht. Bei SCA3 handelt es sich um eine langsam fortschreitende, neurodegenerative Erkrankung, die insbesondere zu einer Atrophie des Zerebellums führt und schwerwiegende Störungen der Koordination, der Motorik sowie der Sprache der betroffenen Patienten auslöst. In den meisten Fällen sind Mutationen im ataxin-3 Gen für die Ausbildung dieser Erbkrankheit verantwortlich. Das Ataxin-3 Protein wirkt als deubiquitylierendes Enzym, jedoch ist die spezifische Funktion innerhalb des Ubiquitin-Proteasom Systems (UPS) unklar. Interessanterweise sind neben SCA3 weitere neurodegenerative Erkrankungen auf Defekte des regulierten Proteinabbaus zurückzuführen. Das Ziel dieser Doktorarbeit ist, mit Hilfe des Modellorganismus Caenorhabditis elegans, Einblicke in die molekularen Mechanismen, die SCA3 zugrunde liegenden, zu gewinnen. Es werden biochemische und genetische Ansätze kombiniert um neue Faktoren zu identifizieren, die an der Pathogenese dieser Polyglutaminerkrankung beteiligt sind. Des Weiteren werden funktionelle in vitro und in vivo Studien dazu beitragen, die physiologische Funktion von Ataxin-3 aufzuklären. Ein Hauptziel des Projekts ist die Etablierung eines Krankheitsmodells. Mit Hilfe darauf aufbauender Komplementationsstudien mit humanem und C. elegans Ataxin-3/ATX-3 können weitere Erkenntnisse über den Zusammenhang zwischen Krankheitserregenden Ataxin-3 Mutationen und der Aggregation von Proteinen erzielt werden.
Lebenslauf
| Name | Roja Barikbin |
| Geburtsort | Elmshorn |
| Geburtsdatum | 29.08.1979 |
| seit 2007 | Doktorarbeit im Bereich des neuronalen Proteinabbaus zum Thema „C. elegans as a modelsystem to analyse Ataxin-3/ATX-3 dependent neurodegeneration“, durchgeführt in der Arbeitsgruppe von Dr. Thorsten Hoppe am Zentrum für Molekulare Neurobiologie Hamburg (ZMNH), Universität Hamburg |
| seit 2007 | Aufbaustudium der Molekularbiologie an der Universität Hamburg |
| 2005/2006 | Diplomarbeit im Bereich Neurobiologie zum Thema „Identifizierung von Interaktionspartnern und Funktionen des Proteins Ataxin-3/ATX-3 innerhalb des Ubiquitin-Proteasom-Systems in C. elegans“, durchgeführt in der Arbeitsgruppe von Dr. Thorsten Hoppe am Zentrum für Molekulare Neurobiologie Hamburg (ZMNH), Universität Hamburg |
| 2000-2005 | Studium der Biologie an der Universität HamburgHauptfach: HumanbiologieNebenfächer: Angewandte Botanik und Ethnologie |
Projektbeschreibung
Die Identifizierung von Proteinen, die an die 5`untranslatierte Region von b-Sekretase binden
Die Alzheimer`sche Krankheit ist heute die weltweit häufigste Form der Altersdemenz. Die charakteristischen Merkmale der Alzheimer Krankheit sind das Absterben von Neuronen, Astrogliosis, Amyloid-Ablagerungen und neurofibrilläre Bündel im Gerhirn. Die Amyloid-Ablagerungen oder Amyloid-Plaques bestehen zum Großteil aus dem 40-42 Aminosäure langem Amyloid b-Peptid (Ab), welches durch proteolytische Prozessierung aus dem Amyloid-Vorläuferprotein (APP) entsteht. Verantwortlich für die Entstehung von Ab sind zwei scherenartige Enzyme, die b-Sekretase (BACE1) und die g-Sekretase. Das scherenartige Enzym a-secretase verhindert dagegen die Bildung von Ab indem es in der Ab-Domäne von APP schneidet. Bei der Analyse von Gehirnen von Alzheimer Patienten konnte gezeigt werden, dass die Proteinexpression der b-Sekretase im Vergleich zu Gehirnen von gesunden Patienten um den Faktor 2,7 ansteigt und somit vermehrt Ab produziert wird. Diese erhöhte b-Sekretase Expression ist allerdings nicht auf eine erhöhte b-Sekretase mRNA Produktion zurückzuführen. Dies deutet daraufhin, dass die Expression der b-Sekretase durch posttranskriptionale Mechanismen reguliert wird. Es wurde gezeigt, dass die 5`untranslierte Region der b-Sekretase die Translation der b-Sekretase mRNA hemmt, aber nicht die Transkription. Eine mögliche Erklärung für diesen Effekt auf die 5`untranslierte Region (5`UTR) von BACE1 sind an die 5`UTR bindende Proteine, die die BACE1 Translation hemmen. Da die Expression der b-Sekretase eine entscheidende Rolle in der Krankheitsentwicklung von Alzheimer spielt, ist das Ziel des Projektes die Regulation der BACE1 Expression besser zu verstehen. Deshalb ist das Ziel meiner Doktorarbeit Proteine zu identifizieren, die an die 5`UTR von BACE1 binden und möglicherweise die Translation der b-Sekretase regulieren. Die Identifizierung und Charakterisierung dieser Proteine soll Erkenntnisse über die Regulation der b-Sekretase Expression auf der translationalen Ebene geben und kann zur Identifikation von Signaltransduktionswegen führen, die bei der Alzheimer`schen Krankheit zu einer erhöhten b-Sekretase Expression führen. Das bessere Verständnis über die Regulation von BACE1 wird möglicherweise neue Strategien für die Medikamentenentwicklung liefern.
Lebenslauf
| Name | Sonja Zilow |
| Geburtsort | Heidelberg |
| Geburtsdatum | 30.12.1980 |
| seit 2005 | Promotion bei Prof. Haass am Adolf-Butenandt-Institut, Ludwig-Maximilians Universität, München |
| 2005 | Masterarbeit: “Analysis of the role of Rer1 in ER-retention of non-assembled gamma-secretase complex components” am Adolf-Butenandt-Institut, Ludwig-Maximilians Universität, München (AG: Prof. Haass, Dr. Kaether) |
| 2004/2005 | Biotechnology, Master of Science an der Fachhochschule für Technik und Gestaltung, Mannheim |
| 2003/2004 | Bachelorarbeit: „Analysis of EphA3 expression in zebrafish“ am Queensland Institute of Medical Research, Brisbane, Australien (AG: Prof. Boyd, Betreuer: Dr. Stringer) |
| 2000-2004 | Biotechnology, Bachelor of Science with Honours an der Fachhochschule für Technik und Gestaltung, Mannheim |
Projektbeschreibung
Eines der Hauptcharakteristika der Alzheimer Erkrankung sind die so genannten senilen (Amyloid-) Plaques deren Hauptbestandteil das Aβ- Peptid ist. Dieses entsteht durch Spaltung (Prozessierung) des Amyloid- Vorläufer- Proteins (APP), katalysiert durch Sekretasen genannte Enzyme, die ihrer Spezifität gemäß als a-, b- und g- Sekretase bezeichnet werden. Das Ab- Peptid entsteht nur, wenn b- und nachfolgend die g- Sekretase das APP schneiden. Spalten jedoch die a- Sekretase (alternativ zur b- Sekretase) und die g- Sekretase das APP, entsteht kein Ab- Peptid. Die Enzymaktivitäten dieser Sekretasen sind innerhalb der Zelle auf unter- schiedliche Regionen verteilt, sodass der Transport von APP zu diesen Regionen einen unmittelbaren Einfluss auf dessen Prozessierung und die Erzeugung des Ab- Peptides hat. Daher kommt der Erforschung der Transportmechanismen von APP und deren Regulation maßgebliche Bedeutung zu. Bei der Regulation von Transportprozessen in Zellen spielen Proteinmotive eine Rolle, die aus bestimmten Aminosäure-Abfolgen bestehen. In APP ist ein solches Proteinmotiv beschrieben, das wichtig für den korrekten Transport von APP zu sein scheint. Das Protein PAT1a kann an dieses Motiv binden und erhält somit eine mögliche Funktion in diesen Prozessen. Zudem wurde gezeigt, dass es die Prozessierung von APP durch die a- und b- Sekretase stimuliert. Entsprechend wurde in Anwesenheit erhöhter Mengen von PAT1a eine erhöhte Produktion des Ab- Peptides beobachtet. Ein weiteres Protein, RME-6, bindet an PAT1a und stellt somit möglicherweise eine Ver- bindung zur Transportmaschinerie der Zelle her. Im Rahmen meiner Doktorarbeit untersuche ich den Einfluss der beiden Proteine PAT1a und RME-6 auf den Transport und die Sortierung von APP innerhalb der Zelle. Dazu werden einerseits Zelltypen verwandt, die keine Asymmetrie in ihrem Aufbau zeigen (sog. nicht- polarisierte Zellen) und andererseits polarisierte Zellen, wie z. B. Nervenzellen, die als Zellausläufer einerseits Axone und andererseits Dendriten besitzen. Diese Untersuchungen werden Erkenntnisse über die molekularen Grundlagen des Transports, der Sortierung und der Prozessierung von APP erbringen und somit wesentlich zum Verständnis der zellulären Mechanismen beitragen, die der Entstehung und dem Verlauf der Alzheimer-Krankheit zugrunde liegen.
Lebenslauf
| Name | Simone Back |
| seit 2005 | Doktorarbeit in der Forschungsgruppe von Prof. Dr. Dr. h.c. K. Beyreuther am Zentrum für Molekulare Biologie der Universität Heidelberg (ZMBH), Deutschland
Titel: Die molekularen Grundlagen des subzellulären Transports der Mitglieder der APP-Genfamilie |
| 2004/ 2005 | Diplomarbeit in der Forschungsgruppe von Prof. Dr. Dr. h.c. K. Beyreuther am Zentrum für Molekulare Biologie (ZMBH) der Universität Heidelberg Deutschland Titel: Untersuchungen zur subzellulären Verteilung von APP in Nervenzellen |
| 2004/2005 | Biotechnology, Master of Science an der Fachhochschule für Technik und Gestaltung, Mannheim |
| 1999-2005 | Biologiestudium mit Abschluss Diplom an der Ruprecht-Karls-Universität in Heidelberg.
Hauptfach: Molekularbiologie, Nebenfächer: Zellbiologie, Zoologie, Abschlussnote: 1,3 |
Projektbeschreibung
Projekt 1:
Obwohl Amyloid-Proteine aus einzigartigen Aminosäuresequenzen bestehen und keines dem anderen gleicht, sind ihre Ultrastruktur und physikochemischen Eigenschaften sehr ähnlich. Ablagerungen von Amyloid-Proteinen im Gehirn werden mit Alzheimer-, Parkinson- und Creutzfeldt-Jakob-Krankheit in Verbindung gebracht. Die Bildung von senilen Plaques und Neurofibrillen ist charakteristisch für die Alzheimer-Krankheit. Doch Plaques und Neurofibrillen treten auch in über einhundert weiteren verwandten Erkrankungen auf. Ein Ligand, der sich selektiv nur an eine Form dieser amyloiden Läsionen bindet, wäre deshalb von enormem Wert für die Diagnose und Be- handlung der Alzheimer-Krankheit. Die Entwicklung von Imidazo [1,2-a] Pyridinen (sog. IMPYs) als radioaktiven Indikatoren für bild- gebende Verfahren zur Darstellung von Amyloid-Proteinen hat einige vielversprechende Verbindungen geliefert, darunter [123I]IMPY, [18F]FPM-IMPY und zuletzt [11C]MeS-IMPY. Alle diese Verbindungen haben ein schnelles Durchdringen der Blut-Hirn-Schranke und vor- zügliches Binden an die entsprechenden Proteine gezeigt. In einer Studie zur Struktur-Wirkungs-Beziehung testeten wir über 30 IMPYs an den folgenden Proteinen: Tau-Protein, Ab-Oligomer, Ab1-42 Fibrillen, g-Sekretase, a-Synuclein und Prion-Protein. Darüber hinaus führten wir histochemische Anfärbeversuche mit Plaques und Neuro- fibrillen aus menschlichem post-mortem Hirnpräparaten durch. Dieser einzigartige, parallele Ansatz erlaubt den Vergleich der Bindungs- eigenschaften der Liganden an die jeweiligen Proteine und liefert somit äußerst wichtige Informationen für die Entwicklung eines selektiven Liganden zur Diagnose und Behandlung der Alzheimer- Krankheit.
Projekt 2:
Zum heutigen Zeitpunkt beruht die post-mortem Diagnose der Alzheimer- Krankheit auf der akkuraten Quantifizierung der krankheits- typischen Amyloid-Proteine und Neurofibrillen. Beim Anfärben mit Hämatoxylin und Eosin färben sich die Amyloid-Proteine genauso wie viele andere Proteine. Die den Amyloid-Proteinen zugrunde liegende Struktur erlaubt ver- schiedene Färbetechniken mit deren Hilfe sie sich optisch heraus- heben lassen, wie z. B. das Färben mit Kongorot, Silber, Thioflavin-S sowie mit immunohistochemischen Färbemethoden. Die Nachteile dieser Methoden sind die unspezifische Bindung an Proteine, Schwankungen in der Färbung, Gewebeschädigung und der Zeit- aufwand für die Versuche. Wir entwickeln mehrere neue histochemische Farbstoffe, die selektiv entweder Amyloid-Proteine oder Neurofibrillen unter einem Fluor- eszenzmikroskop sichtbar machen. Da diese Moleküle darüber hinaus Lipinskis „Rule of Five“ erfüllen, also mit hoher Wahr- scheinlichkeit die Blut-Hirn-Schranke durchdringen, sind sie sowohl für die in vitro- als auch die in vivo-Beobachtung von Amyloid- Proteinen und Neurofibrillen geeignet.
Lebenslauf
| Name | Ali Taghavi |
| Geburtsdatum | 03.09.1980 |
| seit 2006 | Promotionsstudent der Medizinalchemie ; TUD, Darmstadt |
| 2004/2005 | M.Sc in Medizinalchemie; KTH, Stockholm. |
| 2003/2004 | M.Sc in Organischer Chemie ; Ecole Polytechnique, Paris. |
| 1998-2003 | B.Sc Chemische Technologie ; KTH, Stockholm. |
